
ЁОЬтФПЁПЕтдкЕиПЧжажївЊвдNaIO3ЕФаЮЪНДцдкЃЌдкКЃЫЎжажївЊвдI-ЕФаЮЪНДцдкЃЌМИжжЮЂСЃжЎМфЕФзЊЛЏЙиЯЕШчЭМЫљЪОЁЃвбжЊЃКЕэЗлгіЕЅжЪЕтБфРЖЁЃЯТСаЫЕЗЈжаЃЌВЛе§ШЗЕФЪЧЃЈ ЃЉ

A.бѕЛЏадЕФЧПШѕЫГађЮЊЃКCl2 >IO3-- >I2
B.вЛЖЈЬѕМўЯТЃЌ I--гыIO3--ЗДгІПЩФмЩњГЩI2
C.ЯђКЌI--ЕФШмвКжаЭЈШыCl2ЃЌЫљЕУШмвКМгШыЕэЗлШмвКвЛЖЈБфРЖ
D.ЭООЖЂђжаШєЩњГЩ1mol I2ЃЌЯћКФ5mol NaHSO3
ЁОД№АИЁПC
ЁОНтЮіЁП
бѕЛЏЛЙдЗДгІжабѕЛЏадЃКбѕЛЏМС>бѕЛЏВњЮяЁЃ
A.гЩЭООЖIПЩжЊбѕЛЏадCl2ЃОI2ЃЌгЩЭООЖЂђПЩжЊбѕЛЏадI2ЃМNaIO3ЃЌгЩЭООЖЂѓПЩжЊбѕЛЏадCl2ЃОNaIO3ЃЌЙЪбѕЛЏадЕФЧПШѕЫГађЮЊCl2ЃОIO3-ЃОI2ЃЌAе§ШЗЃЛ
B. I-ЮЊ-1МлЃЌIO3-ЮЊ+5МлЃЌдкЫсадЬѕМўЯТЗЂЩњЙщжаЗДгІЃЌдђвЛЖЈЬѕМўЯТЃЌI--гыIO3--ЗДгІПЩФмЩњГЩI2ЃЌBе§ШЗЃЛ
C. ИљОнЭМЪОзЊЛЏЂѓПЩжЊCl2ЃОNaIO3ЃЌвбБфРЖЕФЕэЗл-KIЪджНЭЪЩЋЕФдвђПЩФмЪЧТШЦјНЋЕтбѕЛЏЮЊHIO3ЃЌЯђКЌI-ЕФШмвКжаЭЈШыC12ЃЌЫљЕУШмвКМгШыЕэЗлШмвКВЛвЛЖЈБфРЖЃЌЙЪCДэЮѓЃЛ
D. ЭООЖЂђжаШєЩњГЩ1mol I2ЃЌЕУЕН10molЕчзгЃЌдђЯћКФ5mol NaHSO3ЃЌDе§ШЗЃЛ
Д№АИЮЊCЁЃ


 ЗЂЩЂЫМЮЌаТПЮЬУЯЕСаД№АИ
ЗЂЩЂЫМЮЌаТПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪжГжММЪѕЕФбѕЕчЛЏбЇДЋИаЦїПЩгУгкВтЖЈ O2КЌСПЃЌгвЭМЮЊФГжжбѕЕчЛЏбЇДЋИаЦїЕФдРэЪОвтЭМЁЃвбжЊдкВтЖЈO2КЌСПЙ§ГЬжаЃЌЕчНтжЪШмвКЕФжЪСПБЃГжВЛБфЁЃвЛЖЈЪБМфФкЃЌШєЭЈЙ§ДЋИаЦїЕФД§ВтЦјЬхЮЊaL(Бъ зМзДПі)ЃЌФГЕчМЋдіжиСЫb gЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ

A.PtЕчМЋЮЊИКМЋ
B.ЗДгІЙ§ГЬжазЊвЦOH-ЕФЮяжЪЕФСПЮЊ0.125bmol
C.PbЕчМЋЩЯЗЂЩњЕФЕчМЋЗДгІЮЊPb-2e- +2OH- = PbO+H2O
D.Д§ВтЦјЬххјбѕЦјЕФЬхЛ§ЗжЪ§ЮЊ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛбѕЛЏЬМЁЂЖўбѕЛЏЬМЕФРћгУОпгаЪЎЗжживЊЕФвтвхЃЌПЦбЇМвЬсГівдЯТМИИіЩшЯыЃК
Ђё.ЖўбѕЛЏЬМгыЧтЦјдкДпЛЏМСзїгУЯТПЩжЦШЁЕЭЬМЯЉЬўЁЃдквЛКуШнУмБеШнЦїжаЗжБ№ЭЖШы1molCO2ЁЂ3molH2ЃЌЗЂЩњЗДгІЃК2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ЁїHЃЛдкВЛЭЌЮТЖШЯТЃЌгУДЋИаММЪѕВтГіЦНКтЪБH2ЕФЮяжЪЕФСПБфЛЏЙиЯЕШчЭМЫљЪОЁЃ
C2H4(g)+4H2O(g) ЁїHЃЛдкВЛЭЌЮТЖШЯТЃЌгУДЋИаММЪѕВтГіЦНКтЪБH2ЕФЮяжЪЕФСПБфЛЏЙиЯЕШчЭМЫљЪОЁЃ
ЃЈ1ЃЉЁїH____________ (ЬюЁА>ЁБЁА<ЁБЛђЁАВЛФмШЗЖЈЁБ)0ЁЃ
ЃЈ2ЃЉШєВтЪджаЬхЯЕФкЮобѕЦјВњЩњЃЌЪдНсКЯЭМЪОЭЦЖЯШШЮШЖЈадЃКC2H4_______(ЬюЁА>ЁБ ЁА<ЁБЛђЁАВЛФмШЗЖЈЁБ)H2OЁЃ
Ђђ.МзДМЪЧживЊЕФЛЏбЇЙЄвЕЛљДЁдСЯКЭЧхНрвКЬхШМСЯЁЃЙЄвЕЩЯПЩРћгУCOЛђCO2РДЩњВњШМСЯМзДМЁЃвбжЊМзДМжЦБИЕФгаЙиЛЏбЇЗДгІвдМАдкВЛЭЌЮТЖШЯТЕФЛЏбЇЗДгІЦНКтГЃЪ§ШчЯТБэЫљЪОЃК
ЛЏбЇЗДгІ | ЦНКт ГЃЪ§ | ЮТЖШЁц | |
500 | 800 | ||
Ђй2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
ЂкH2(g)+CO2(g) | K2 | 1.0 | 2.50 |
Ђл3H2(g)+CO2(g) | K3 | ||
ЃЈ1ЃЉФГЮТЖШЯТЗДгІЂйжаH2ЕФЦНКтзЊЛЏТЪЃЈaЃЉгыЬхЯЕзмбЙЧП(P)ЕФЙиЯЕЃЌШчзѓЯТЭМЫљЪОЁЃдђЦНКтзДЬЌгЩAБфЕНBЪБЃЌЦНКтГЃЪ§K(A)_____________K(B)ЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБЃЉЁЃОнЗДгІЂйгыЂкПЩЭЦЕМГіK1ЁЂK2гыK3жЎМфЕФЙиЯЕЃЌдђK3=_______ЃЈгУK1ЁЂK2БэЪОЃЉЁЃ
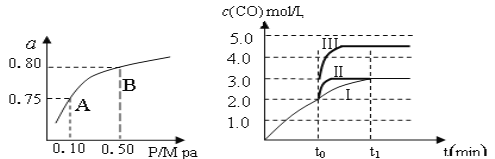
ЃЈ2ЃЉдк3 LШнЛ§ПЩБфЕФУмБеШнЦїжаЗЂЩњЗДгІЂкЃЌвбжЊ
ЕБЧњЯпЂёБфЮЊЧњЯпЂѓЪБЃЌИФБфЕФЬѕМўЪЧ_____________________ЁЃ
ЃЈ3ЃЉвЛжжМзДМШМСЯЕчГиЃЌЪЙгУЕФЕчНтжЪШмвКЪЧ2molЁЄLЃ1ЕФKOHШмвКЁЃ
ЧыаДГіМгШы(ЭЈШы)bЮяжЪвЛМЋЕФЕчМЋЗДгІЪН_________________ЃЛУПЯћКФ6.4gМзДМзЊвЦЕФЕчзгЪ§ЮЊ_______________ЁЃ
ЃЈ4ЃЉвЛЖЈЬѕМўЯТМзДМгывЛбѕЛЏЬМЗДгІПЩвдКЯГЩввЫсЁЃЭЈГЃзДПіЯТЃЌНЋa mol/LЕФДзЫсгыb mol/LBa(OH)2ШмвКЕШЬхЛ§ЛьКЯКѓЃЌШмвКжаЃК2c(Ba2ЃЋ)= c(CH3COO-)ЃЌгУКЌaКЭbЕФДњЪ§ЪНБэЪОИУЛьКЯШмвКжаДзЫсЕФЕчРыГЃЪ§KaЮЊ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЦјЁЂТСЁЂЬњЖМЪЧживЊЕФЛЙдМСЃЌвбжЊЯТСаЗДгІЕФШШЛЏбЇЗНГЬЪНЃЌЯТСаЙигкЗДгІЕФьЪБфХаЖЯе§ШЗЕФЪЧ
2H2(g)+O2(g)===2H2O(g) ЁїH1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) ЁїH2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) ЁїH3
2Al(s)+3/2O2(g)===Al2O3(s) ЁїH4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) ЁїH5
A. ЁїH1<0ЃЛЁїH3>0 B. ЁїH5<0ЃЛЁїH4<ЁїH3
C. ЁїH1=ЁїH2+ЁїH3 D. ЁїH3=ЁїH4+ЁїH5
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧ
A. ФГУмБеШнЦїжаЪЂга0.2 mol SO2КЭ0.1 mol O2ЃЌвЛЖЈЬѕМўЯТГфЗжЗДгІЃЌЩњГЩSO3ЗжзгЪ§аЁгк0.2 NA
B. вЛЖЈЬѕМўЯТЃЌ2.3 g NaгыO2ЭъШЋЗДгІЩњГЩ3.6 gВњЮяЪБЪЇШЅЕФЕчзгЪ§0.1 NA
C. 25ЁцЪБЃЌpHЃН13ЕФBa(OH)2ШмвКжаКЌгаOHЃЕФЪ§ФПЮЊ 0.1 NA
D. 20g D2OжаКЌгаЕФжЪзгЪ§ЮЊ10 NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПЦбЇМвбажЦСЫвЛжжаТаЭЕФИпБШФмСПаПЕтфхвКСїЕчГиЃЌЦфЙЄзїдРэЪОвтЭМШчЯТЁЃЭМжажќвКЦїПЩДЂДцЕчНтжЪШмвКЃЌЬсИпЕчГиЕФШнСПЁЃ
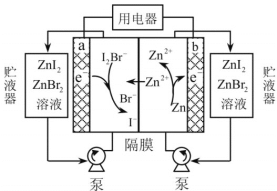
ЯТСаа№ЪіВЛе§ШЗЕФЪЧЃЈ ЃЉ
A.ЗХЕчЪБЃЌaЕчМЋЗДгІЮЊI2Br-+2e- =2I-+ Br-
B.ЗХЕчЪБЃЌШмвКжаРызгЕФЪ§ФПдіДѓ
C.ГфЕчЪБЃЌbЕчМЋУПМѕЩй0.65gЃЌШмвКжага0.02mol I-- БЛбѕЛЏ
D.ГфЕчЪБЃЌaЕчМЋНгЭтЕчдДе§МЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаШмвКжаЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕВЛе§ШЗЕФЪЧ![]()
A.ШєНЋЪЪСП![]() ЭЈШы
ЭЈШы![]()
![]()
![]() ШмвКжажСШмвКЧЁКУГЪжаадЃЌдђШмвКжа
ШмвКжажСШмвКЧЁКУГЪжаадЃЌдђШмвКжа![]() ВЛПМТЧШмвКЬхЛ§БфЛЏ
ВЛПМТЧШмвКЬхЛ§БфЛЏ![]() ЃК2
ЃК2![]()
![]()
![]()
B.ФГШмвКжагЩЫЎЕчРыГіЕФ![]() ЃЌШє
ЃЌШє![]() ЪБЃЌдђИУШмвКpHвЛЖЈЮЊ
ЪБЃЌдђИУШмвКpHвЛЖЈЮЊ![]()
C.ГЃЮТЯТНЋЯрЭЌЬхЛ§ЕФ![]() СђЫсКЭ
СђЫсКЭ![]() вЛдЊМюBOHШмвКЛьКЯЃЌЫљЕУШмвКПЩФмЮЊжаадвВПЩФмЮЊМюад
вЛдЊМюBOHШмвКЛьКЯЃЌЫљЕУШмвКПЩФмЮЊжаадвВПЩФмЮЊМюад
D.ЕШЬхЛ§ЕШЮяжЪЕФСПХЈЖШЕФNaClOШмвКгыNaClШмвКжаРызгзмЪ§ДѓаЁЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉ![]() ГШЩЋ
ГШЩЋ![]() дкЫЎжаЛсВПЗжзЊЛЏЮЊ
дкЫЎжаЛсВПЗжзЊЛЏЮЊ![]() ЛЦЩЋ
ЛЦЩЋ![]() ЃЌИУЙ§ГЬПЩгУРызгЗДгІЗНЪНБэЪОЮЊЃК ______ ЃЛдк
ЃЌИУЙ§ГЬПЩгУРызгЗДгІЗНЪНБэЪОЮЊЃК ______ ЃЛдк![]() ШмвКжаМгШызуСПЕФNaOHШмвКЃЌШмвКбеЩЋЛсЭъШЋБфГЩЛЦЩЋЃЌИУЙ§ГЬПЩгУЛЏбЇЗДгІЗНЪНБэЪОЮЊЃК ______ ЁЃ
ШмвКжаМгШызуСПЕФNaOHШмвКЃЌШмвКбеЩЋЛсЭъШЋБфГЩЛЦЩЋЃЌИУЙ§ГЬПЩгУЛЏбЇЗДгІЗНЪНБэЪОЮЊЃК ______ ЁЃ
ЃЈ2ЃЉЫЎКЯВнЫсОЇЬхЕФзщГЩПЩБэЪОЮЊ![]() ЃЌЮЊВтЖЈxЕФжЕЃЌзіСЫШчЯТЪЕбщЃК
ЃЌЮЊВтЖЈxЕФжЕЃЌзіСЫШчЯТЪЕбщЃК
ЂйГЦШЁWgДПВнЫсОЇЬхЃЌНЋЦфХфжЦГЩ100mLЫЎШмвКЮЊД§ВтвКЃЛ
ЂкШЁ25mLД§ВтвКЗХШызЖаЮЦПжаЃЌдйМгШыЪЪСПЕФЯЁ![]() ЃЛ
ЃЛ
ЂлгУХЈЖШЮЊa![]() ЕФ
ЕФ![]() БъзМШмвКНјааЕЮЖЈ
БъзМШмвКНјааЕЮЖЈ![]() ЕЮЖЈЙ§ГЬжага
ЕЮЖЈЙ§ГЬжага![]() ЁЂ
ЁЂ![]() ЩњГЩ
ЩњГЩ![]() ЃЌ
ЃЌ
ЧыЛиД№ЃКЂйаДГіЕЮЖЈЪБЗЂЩњЕФЗДгІЕФРызгЗНГЬЪНЮЊЃК ______ ЃЌ
ЂкЕЮЖЈЪБЃЌНЋ![]() БъзМвКзАдк ______ ЪНЕЮЖЈЙмжаЃЌ
БъзМвКзАдк ______ ЪНЕЮЖЈЙмжаЃЌ
ЂлМйЩшЕЮЖЈжеЕуЪБЃЌгУШЅVmL![]() ШмвКЃЌдђД§ВтВнЫсШмвКЕФЮяжЪЕФСПХЈЖШЮЊ ______
ШмвКЃЌдђД§ВтВнЫсШмвКЕФЮяжЪЕФСПХЈЖШЮЊ ______ ![]() ЃЌ
ЃЌ
ЂмдкЩЯЪіЪЕбщжаЃЌЯТСаВйзї![]() ЦфЫћВйзїе§ШЗ
ЦфЫћВйзїе§ШЗ![]() ЛсдьГЩВтЖЈНсЙћxжЕЦЋИпЕФга ______
ЛсдьГЩВтЖЈНсЙћxжЕЦЋИпЕФга ______ ![]() ЬюзжФИ
ЬюзжФИ![]() ЃЌ
ЃЌ
AЁЂЕЮЖЈжеЕуЖСЪ§ЪБИЉЪгЖСЪ§BЁЂЫсЪНЕЮЖЈЙмЪЙгУЧАЃЌЫЎЯДКѓЮДгУБъзМвКШѓЯД
CЁЂзЖаЮЦПЫЎЯДКѓдйгУД§ВтвКШѓЯДDЁЂЕЮЖЈЪБЫљгУЕФ![]() ШмвКвђОУжУЖјЕМжТХЈЖШБфаЁЁЃ
ШмвКвђОУжУЖјЕМжТХЈЖШБфаЁЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВ№ПЊ1 molЙВМлМќЫљЮќЪеЕФФмСПЛђаЮГЩ1 molЙВМлМќЫљЪЭЗХЕФФмСПГЦЮЊМќФмЁЃвбжЊЃКHЁЊHМќФмЮЊ436 kJ/molЃЌHЁЊNМќФмЮЊ391 kJ/molЃЌN2 (g)+ 3H2(g) ![]() 2NH3(g) ІЄH=92.4 kJ/molЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ( )
2NH3(g) ІЄH=92.4 kJ/molЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ( )
A.HЁЊHБШNЁдNИќРЮЙЬ
B.NЁдNМќФмдМЮЊ945.6 kJ/mol
C.КЯГЩАБЗДгІбЁдёЪЪЕБЕФДпЛЏМСЪЧЮЊСЫЬсИпH2ЕФзЊЛЏТЪ
D.0.5 mol N2КЭ1.5 mol H2дкЬтИјЬѕМўЯТГфЗжЗДгІЃЌЗХГіШШСПЮЊ46.2 kJ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com