
| A. | ①②③⑤ | B. | ②④⑤⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
分析 ①硅用于半导体材料;
②明矾可水解生成具有吸附性的氢氧化铝胶体;
③铁红为氧化铁,性质稳定,颜色为红色;
④根据玻璃的主要成分判断;
⑤水玻璃可用作阻燃剂;
⑥氯气不具有漂白性,具有漂白性的是氯气和水反应生成的次氯酸.
解答 解:①硅用于半导体材料,二氧化硅用于制造光导纤维,故①错误;
②明矾可水解生成具有吸附性的氢氧化铝胶体,可用于净水,故②正确;
③铁红为氧化铁,性质稳定,颜色为红色,可用作红色油漆和涂料,故③正确;
④玻璃中含有二氧化硅、硅酸钠、硅酸钙等,可用SiO2、Na2CO3和CaCO3作原料,故④正确;
⑤水玻璃主要成分为硅酸钠,耐高温,不燃烧,可用作阻燃剂,故⑤正确;
⑥氯气不具有漂白性,不能直接使有色布条褪色,必须是使湿润的有色布条褪色,具有漂白性的是次氯酸,故⑥错误.
故选D.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,难度不大.


科目:高中化学 来源: 题型:填空题
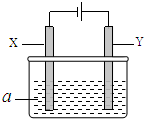 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | AgNO3 |
| D | 铁 | 银 | Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢离子浓度相同 | |
| B. | 导电能力相同 | |
| C. | 相同体积时,中和NaOH的能力相同 | |
| D. | 加水稀释10倍后,溶液的pH值均上升1个单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 冷的氢氧化钠溶液中通入氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2 BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L | B. | 0.5L | C. | 0.3L | D. | 0.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com