
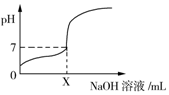
 常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )
常温下,用0.1mol/L的NaOH溶液滴定20mL同浓度的一元弱酸HA,滴定过程中溶液pH随NaOH溶液体积变化曲线如图所示(忽略中和热效应),下列说法正确的是( )| A. | X=20 | |
| B. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{{c({A^-})}}$的值减小 | |
| C. | 0.1 mol/L的NaOH溶液中,由水电离出的c(OH-)=0.1 mol/L | |
| D. | 加入NaOH溶液体积为X mL时,溶液中c(A-)=0.05 mol/L |
分析 A.X=20时二者恰好反应生成强碱弱酸盐NaA,溶液呈碱性,而加入X的对应pH=7;
B.稀释后HA的电离程度增大,则HA的物质的量减小、A-的物质的量增大;
C.氢氧化钠溶液抑制了水的电离,溶液中氢离子 是水的电离的;
D.加入NaOH溶液体积为X mL时,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(A-)=c(Na+),结合X<20分析.
解答 解:A.HA为弱酸,X=20mL时,20mL 0.1mol/L的NaOH溶液与20mL同浓度的一元弱酸HA反应生成强碱弱酸盐NaA,所得溶液呈碱性,溶液的pH>7,若满足溶液的pH=7,则加入的氢氧化钠溶液体积X<20,故A错误;
B.HA溶液加水稀释后,HA的电离程度增大,则n(HA)减小、n(A-)增大,由于溶液体积相同,则溶液中$\frac{c(HA)}{{c({A^-})}}$=$\frac{n(HA)}{n({A}^{-})}$的值减小,故B正确;
C.0.1 mol/L的NaOH溶液中c(OH-)=0.1 mol/L,氢氧根离子抑制了水的电离,溶液中氢离子是水的电离的,则由水电离出的c(OH-)=c(H+)$\frac{1×1{0}^{-14}}{0.1}$mol/L=1×10-13mol/L,故C错误;
D.加入NaOH溶液体积为X mL时溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(A-)=c(Na+),由于结合X<20,则c(A-)=c(Na+)>0.05mol/L,故D错误;
故选B.
点评 本题考查溶液酸碱性与溶液pH的关系,题目难度中等,正确判断X的范围为解答关键,注意掌握溶液酸碱性与溶液pH关系,D为易错点,注意溶液体积小于原先的2倍,试题培养了学生的分析能力及综合应用能力.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 在25℃、1.01×105Pa时,11.2L氮气所含的原子数目为NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有的离子总数为0.3NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 1molP4和1molCH4中含有的共价健数均为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
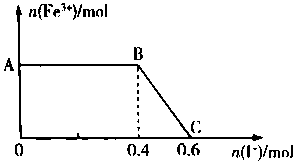 将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:
将FeC12溶液与过量氯水(视溶质为Cl2)混合,发生反应:Cl2+ZFeCl2=2FeCl3,得到溶液X.向溶液X中加入KI溶液,混合溶液中Fe3+的物质的量随加入KI的物质的量的变化关系如图所示.已知Cl2、FeCl3均可将I-氧化为I2,其自身分别被还原为Cl-、Fe2+.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
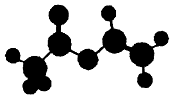 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
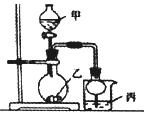
| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 浓硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红红褪色 |
| B | 浓盐酸 | KMnO4 | 淀粉-Kl溶液 | 溶液变蓝 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
| t1 | t2 | |||
| 1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
| 2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| B. | 12gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com