
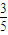 mol,根据①②化学方程式计算可知,消耗甲烷
mol,根据①②化学方程式计算可知,消耗甲烷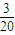 mol;同理NO占
mol;同理NO占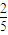 mol,消耗甲烷
mol,消耗甲烷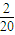 mol,共计消耗甲烷
mol,共计消耗甲烷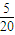 mol=0.25mol,故A错误;
mol=0.25mol,故A错误;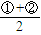 可得:
可得: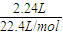 ×[+4-(-4)]=0.8mol,故D正确;
×[+4-(-4)]=0.8mol,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年江西省名校高考信息卷理综试卷(二)化学部分 题型:选择题
一定条件下,氮氧化物 (NOx)形成的污染可以用甲烷来消除。已知:
① CH4(g)+4NO2(g)-4NO(g)+ CO2(g)+2H2O(g); ⊿H=-574kJ/mol
② CH4(g)+4NO(g)-2N2(g)+ CO2(g)+2H2O(g); ⊿H=-1160kJ/mol
下列选项正确的是
A. x=1.6时,每消除1mol氮氧化物需消耗0.5mol CH4
B. CH4(g)+2NO2(g)-N2(g)+ CO2(g)+2H2O(l); ⊿H≥-867kJ/mol
C.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为287 kJ
D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为0.8mol
查看答案和解析>>
科目:高中化学 来源:江西模拟 题型:单选题
| A.x=1.6时,每消除1mol氮氧化物需消耗0.5mol CH4 |
| B.CH4(g)+2NO2(g)-N2(g)+CO2(g)+2H2O(l);△H=>-867kJ/mol |
| C.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为287 kJ |
| D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,氮氧化物 (NOx)形成的污染可以用甲烷来消除。已知:
① CH4(g)+4NO2(g)-4NO(g)+ CO2(g)+2H2O(g); ⊿H=-574kJ/mol
② CH4(g)+4NO(g)-2N2(g)+ CO2(g)+2H2O(g); ⊿H=-1160kJ/mol
下列选项正确的是
A. x=1.6时,每消除1mol氮氧化物需消耗0.5mol CH4
B. CH4(g)+2NO2(g)-N2(g)+ CO2(g)+2H2O(l); ⊿H≥-867kJ/mol
C.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为287 kJ
D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com