
| A. | Na2SiO3水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | Fe3O4俗称铁红,可用作红色涂料 | |
| C. | Na2CO3俗称纯碱,可作为制造玻璃的原料 | |
| D. | KAl(SO4)2•12H2O俗称明矾,可作为净水剂 |
分析 A.硅酸钠熔点高,可用于阻燃剂;
B.氧化铁俗称铁红,可用于作油漆、红色涂料;
C.碳酸钠俗称纯碱或苏打,是白色固体,广泛用于玻璃、造纸等工业;
D.明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质.
解答 解:A.硅酸钠熔点高,可用于阻燃剂,可防止木材燃烧,故A正确;
B.氧化铁俗称铁红,可用于作油漆、红色涂料,不是四氧化三铁,故B错误;
C.制造普通玻璃的原料是纯碱(Na2CO3)、石灰石(CaCO3)和石英(SiO2),碳酸钠俗称纯碱,故C正确;
D.明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,反应的离子方程式为:Al3++3H2O=Al(OH)3(胶体)+3H+,故D正确;
故选B.
点评 本题考查化学与生活紧密联系的知识,掌握钠、硅、铝及其化合物的知识是解答关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
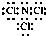 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.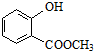 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
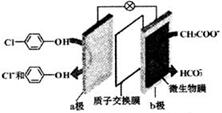 利用微生物电池处理含乙酸钠和对氯酚(
利用微生物电池处理含乙酸钠和对氯酚(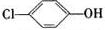 )的废水,工作原理如图所示.下列说法正确的是( )
)的废水,工作原理如图所示.下列说法正确的是( )| A. | 电极b是正极 | B. | 质子从a极移向b极 | ||
| C. | 处理后的废水pH升高 | D. | a极的电极反应式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
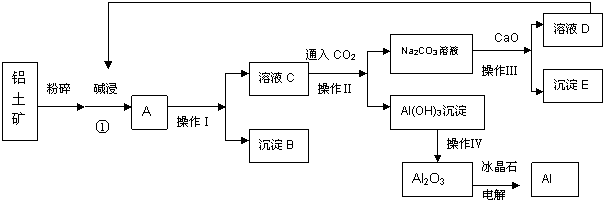
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com