
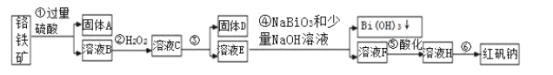
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
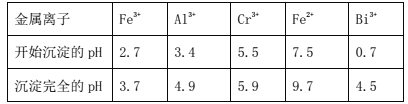
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
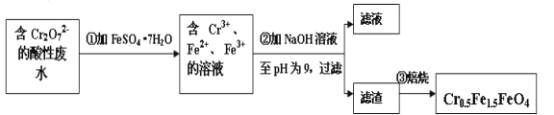
(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
【答案】加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条) SiO2 4.9≤pH<5.5 使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3 + 2Cr3+ +7OH- + H2O = 2Cr2O72 + 3Bi(OH)3↓+3Na+ 蒸发浓缩、冷却结晶、过滤洗涤干燥 Cr2O72 + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O 6.4×1014 2.78
【解析】
铬铁矿中的FeO、Cr2O3和Al2O3均能溶于硫酸,SiO2不溶,过滤,向滤液中加入双氧水,氧化亚铁离子,步骤③的目的是使Fe3+、Al3+沉淀,过滤,向滤液中加入NaBiO3、NaOH,能将Cr3+转化为Cr2O72,过滤,将滤液蒸发浓缩、冷却结晶、过滤洗涤干燥得到Na2Cr2O7·2H2O。
⑴加热、搅拌、粉碎、适当提高稀硫酸的浓度均可加快化学反应速率,任答一种即可。按照元素化合物知识,铬铁矿中的FeO、Cr2O3和Al2O3均能溶于硫酸,SiO2不溶,故第①步得到的固体A为SiO2;故答案为:加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条);SiO2。
⑵步骤③的目的是使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,但不能使Cr3+沉淀,故需要调节的pH范围为4.9≤pH<5.5,故答案为:4.9≤pH<5.5;使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去。
⑶常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为Cr2O72,则反应的离子方程式为3NaBiO3 + 2Cr3+ +7OH- + H2O = 2Cr2O72 + 3Bi(OH)3↓+3Na+;故答案为:3NaBiO3 + 2Cr3+ +7OH- + H2O = 2Cr2O72 + 3Bi(OH)3↓+3Na+。
⑷溶液H得红矾钠粗晶体需经过蒸发浓缩、冷却结晶、过滤洗涤干燥;故答案为:蒸发浓缩、冷却结晶、过滤洗涤干燥。
⑸Cr2O72有强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据元素守恒及所处环境可知,还有水生成,反应离子方程式为Cr2O72 + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O;故答案为:Cr2O72 + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O。
⑹常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据得到Cr3+开始沉淀时pH =5.5,即![]() ,则
,则![]() ,步骤②加入NaOH溶液调节溶液的pH至9时,
,步骤②加入NaOH溶液调节溶液的pH至9时,![]() ,则溶液中Cr3+的浓度为
,则溶液中Cr3+的浓度为![]() ,
,![]() ;故答案为;6.4×1014 mol·L1。
;故答案为;6.4×1014 mol·L1。
⑺欲使1L该废水中n(Cr2O72)=1×103 mol,根据Cr原子、Fe原子守恒,可得Cr2O72~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,因此理论上n(FeSO4·7H2O)=10n(Cr2O72)=10×1×103 mol =0.01mol,所以质量m(FeSO4·7H2O) = 0.01mol×278 gmol1=2.78g;故答案为


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
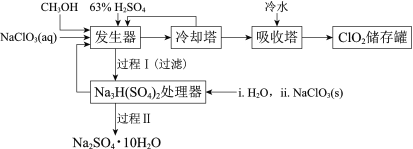
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
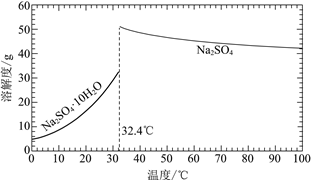
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期表分析下列判断,其中错误的是( )
A.铍(Be)的氧化物的水合物可能是两性氧化物
B.硒化氢(![]() )是有色、有毒的气体,比
)是有色、有毒的气体,比![]() 稳定
稳定
C.![]() 的酸性比
的酸性比![]() 的酸性弱
的酸性弱
D.砹(At)为有色固体,HAt不稳定,AgAt感光性强,不溶于一般的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物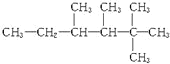 用系统命名法命名_________
用系统命名法命名_________
(2)若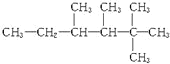 是某单烯烃与氢气加成后的产物,则该烯烃可能有___________种结构;若是某炔烃与氢气加成后的产物,则此炔烃可能有___________种结构。
是某单烯烃与氢气加成后的产物,则该烯烃可能有___________种结构;若是某炔烃与氢气加成后的产物,则此炔烃可能有___________种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是重要的化工原料,根据要求填写下列空格。
)是重要的化工原料,根据要求填写下列空格。
(1)苯乙烯中含官能团的名称是_________________,苯乙烯合成聚苯乙烯的化学方程式是__________________________________
(2)取10.4g苯乙烯与足量氢气反应,消耗标况下氢气的体积为___________L,生成产物的结构简式为______________,其一氯代物共有___________种。
(3)下列属于苯乙烯的性质有___________
A.能溶于水 B.能发生氧化反应
C.能发生缩聚反应 D.常温常压下为气体
(4)苯乙烯属于___________
A.环烷烃 B.不饱和烃 C.烯烃 D.芳香烃
(5)苯乙烯和氯气加成产物H,写出H与氢氧化钠溶液共热的化学方程式___________________________。其反应类型是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL0.lmol/L胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL0.lmol/L胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
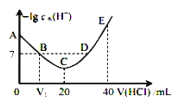
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为C点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+2c(NH2OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,表中a~f代表六种短周期主族元素。完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_________ (填元素编号) 。d、e、f三种元素的原子结构上的相同点是________________________________。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是___________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)。
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性_________(选填“强”、“弱’’),能说明这一事实的化学方程式是____________________(任写一个)。
(4)若b为非金属元素,则以下推断正确的是_________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜是被人们认识和利用较早的金属之一,西汉《淮南万毕术》中有“曾青得铁则化为铜”的记载,“曾青”是CuSO4溶液。回答下列问题:
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是___。
(2)CuSO4溶液中,金属阳离子的最高能层符号为___;其中未成对电子数为___。
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为___。1mol[Cu(H2O)4]2+中含有σ键的个数为___(NA表示阿伏加德罗常数的值)。
②CuSO4·5H2O结构中含有的化学键的类型有___,所含元素的电负性大小顺序为___。
(4)金属铜的晶胞结构如图所示。
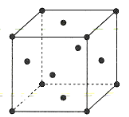
①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为___。
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为___pm(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com