
 NaHNa+[:H]- CsOH
NaHNa+[:H]- CsOH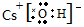 HSCN
HSCN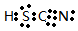 O22-
O22- .
. 分析 (1)根据是否发生化学反应判断化学键是否被破坏,根据物质中存在的化学键判断破坏的化学键类型;
(2)只含有共价键的化合物属于共价化合物,含有离子键的化合物属于离子化合物;
(3)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
解答 解:(1)①碘的升华属于物理变化,只是状态发生变化,没有化学键的破坏;
②烧碱熔化中存在离子键,融化烧碱时,阴阳离子间的化学键被破坏,所以破坏的是离子键;
③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏,所以破坏的是离子键;
④氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被破坏,所以破坏的是共价键;
⑤氧气溶于水,属于物理变化,没有发生电离,没有化学键的破坏;
⑥氯化铵受热分解,氯化铵是离子化合物,存在的化学键有离子键、共价键,受热分解时,阴阳离子间的化学键、及铵根离子中的共价键被破坏,所以所以破坏的是离子键、共价键;
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
故答案为:①⑤;②③;
(2)只含有共价键的化合物属于共价化合物,所以属于共价化合物的是④,含有离子键的化合物属于离子化合物,属于离子化合物的是②③⑥;
故答案为:④;②③⑥;
(3)As原子最外层有5个电子,电子式为 ;
;
NaH是离子化合物,由Na+和H-离子组成,电子式为Na+[:H]-;
CsOH是由铯离子和氢氧根离子构成的离子化合物,氢氧根离子中O与H以共价键相结合,其电子式为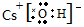 ;
;
HSCN是共价化合物,其电子式为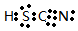 ;
;
O22-中,氧原子之间形成的是非极性共价单键,并且有1对共用电子,电子式为 ;
;
故答案为: ;Na+[:H]-;
;Na+[:H]-;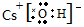 ;
;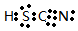 ;
; .
.
点评 本题考查了离子键、共价键的区别、电子式的书写,侧重考查学生对概念的辨别能力,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


科目:高中化学 来源: 题型:多选题
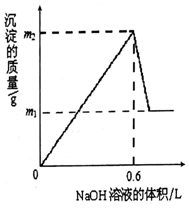 将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )
将m1g铜铝合金投入到1LH2SO4和HNO3的混合溶液中,完全溶解后只生成VLNO气体(标准状况),向反应后的溶液中逐渐加入1mol/LNaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如图所示.下列说法中不正确的是( )| A. | m1-m2═10.2 | B. | 2c(H2SO4)+c(HNO3)═0.8 mol•L-1 | ||
| C. | 原合金中铝的质量分数为34.7% | D. | V=2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH<7 | B. | 得到澄清透明溶液 | ||
| C. | 得到浑浊液 | D. | 先有白色沉淀生成,后逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.969 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.
“化学--人类进步的关键”.化学在生产生活中有着广泛的运用,尤其是化学反应原理.人们平时所用的铁及其化合物都跟化学有关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O | B. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | ||
| C. | Al(OH)3+3HNO3═Al(NO3)3+3H2O | D. | 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某放热反应能自发进行,因此该反应是熵增反应 | |
| B. | 用惰性电极电解含有 H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子 | |
| C. | 反应 A(g)?B(g)△H,若正反应的活化能为 EakJ/mol,逆反应的活化能为 EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| D. | 3x%的 A 物质的溶液与 x%的 A 物质的溶液等体积混合后溶液质量分数小于 2x%,则 A 可 能为乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com