
| A. | 还原剂发生还原反应 | B. | 一定有氧元素参与反应 | ||
| C. | 一定有元素化合价升降 | D. | 氧化剂失去电子,化合价升高 |
科目:高中化学 来源: 题型:选择题
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中的陶瓷、水泥、玻璃等是使用量最大的无机非金属材料 | |
| B. | 制饭勺、高压锅等的不锈钢是合金.合金有许多优良的性能,如熔点比成分金属高 | |
| C. | 防止或减少雾霾形成的措施之一是减少煤的燃烧和机动车的使用 | |
| D. | 食品干燥剂应无毒、无味、无腐蚀性及环境友好,硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
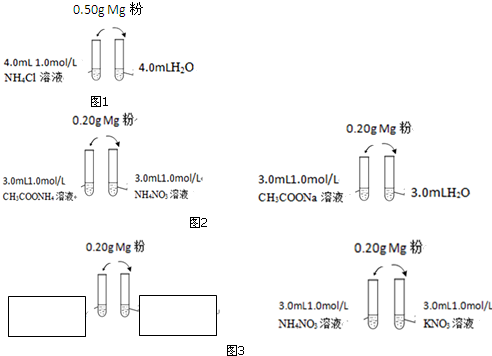
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C分别与D形成的化合物的热稳定性依次减弱 | |
| B. | B、D原子构成的一种分子B2D4只含有极性共价单键 | |
| C. | B、C、D三种元素可以形成酸、碱或者盐三种物质 | |
| D. | C的离子半径小于E的离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定属于氧化还原反应 | |
| B. | 在反应中一定有沉淀、气体或水生成 | |
| C. | 肯定有一种元素被氧化,另一种元素被还原 | |
| D. | 分解反应和复分解反应有可能是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL 1mol/L的AlCl3溶液 | B. | 75mL 2mol/L的NaCl溶液 | ||
| C. | 100mL 1.5mol/L的NH4Cl溶液 | D. | 150mL 1mol/L的KCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com