
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
分析 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀;
(3)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,根据溶液中的溶质性质确定离子浓度关系;
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度=$\frac{10{\;}^{-14}}{10{\;}^{-11}}$=10-3 mol/L,根据C(OH-)=$\frac{n(OH{\;}^{-})-n(H{\;}^{+})}{混合溶液体积}$计算氢氧化钡和盐酸的体积之比.
解答 解:有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠,
(1)通过以上分析知,A是醋酸钠,化学式为CH3COONa,B是氯化铵,化学式为NH4Cl,
故答案为:CH3COONa;NH4Cl;
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀,离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓;
(3)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,溶液中氢氧根离子浓度最大,钡离子和氯离子浓度相等,氨水是弱碱部分电离导致氯离子浓度大于铵根离子浓度,溶液呈碱性,氢离子浓度最小,所以溶液中离子浓度大小顺序是c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),
故答案为:c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+);
(4)混合溶液的pH=11,则溶液中氢氧根离子浓度=$\frac{10{\;}^{-14}}{10{\;}^{-11}}$=10-3 mol/L,设氢氧化钡的体积为X,盐酸的体积为Y,c(OH-)=$\frac{n(OH{\;}^{-})-n(H{\;}^{+})}{混合溶液体积}$=$\frac{0.005×2×X-0.00125Y}{X+Y}$=10-3 mol/L,X:Y=1:4,
故答案为:1:4.
点评 本题以化合物的推断为载体考查了物质的量的有关计算、离子浓度大小的比较等知识点,明确物质的性质是推断化合物的关键,本题的难点是判断溶液中离子浓度大小的比较,根据物料守恒和电荷守恒来判断即可,难点较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
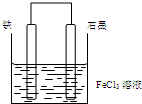
| A. | 电子从石墨棒经外电路流向铁棒 | |
| B. | 总反应为2Fe3++Fe=3 Fe2+ | |
| C. | 石墨电极上发生氧化反应 | |
| D. | 铁电极逐渐变细,石墨电极逐渐变粗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 4:3 | C. | 3:4 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaSiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL量筒量取12.36mL浓硫酸 | |
| B. | 用托盘天平称量5.85g食盐 | |
| C. | 用500mL的容量瓶配制500mL0.2 mol/L盐酸溶液 | |
| D. | 用广泛pH试纸测得某溶液的pH为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3,产生沉淀 | |
| B. | 二氧化硫可广泛用于食品的增白 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
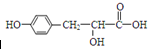 的说法中,正确的是( )
的说法中,正确的是( )| A. | 在核磁共振氢谱中有五组吸收峰 | |
| B. | 与 互为同分异构体 互为同分异构体 | |
| C. | 1mol 该有机物与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | 可以发生取代反应、加成反应、消去反应和缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
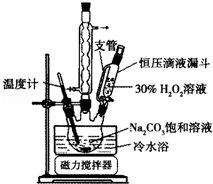 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com