
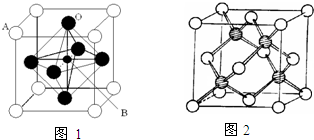
 过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、乙烯使溴水、酸性高锰酸钾溶液褪色的原理相同 |
| B、乙醇可被直接氧化生成乙酸且乙醇与都能与单质钠反应 |
| C、淀粉、蔗糖、葡萄糖、蛋白质在稀硫酸中均能发生水解反应 |
| D、淀粉和聚乙烯都是天然的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某中学实验室的一瓶硫酸试剂标签上的部分内容.
如图是某中学实验室的一瓶硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:

| 模拟海水中的离子 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 浓度(mol/L) | 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤④①②③ |
| B、⑤①④②③ |
| C、④①②⑤③ |
| D、③②④①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com