
【题目】五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处于另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。D的周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是__________________ (用元素符号填写),其中D的最高价氧化物是________氧化物(填“酸性”“碱性”或“两性”)。
(2)乙物质中存在的化学键类型是________。
(3)化合物乙的电子式为________。
(4)写出C与D分别对应的最高价氧化物的水化物反应的离子方程式:_____________________。
【答案】O<N<Cl<Al<Na 两性 离子键、共价键 ![]() OH-+Al(OH)3=AlO2-+2H2O
OH-+Al(OH)3=AlO2-+2H2O
【解析】
A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,A原子只能有2个电子层,最外层电子数为5,故A为N元素;A、B处于同一周期,C、D、E同处另一周期,则B处于第二周期,C、D、E处于第三周期,D的周期序数等于D原子最外层电子数,则D为Al,E原子半径是同周期中最小的(除稀有气体外),可以知道E为Cl,而C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2,据此答题。
A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,A原子只能有2个电子层,最外层电子数为5,故A为N元素;A、B处于同一周期,C、D、E同处另一周期,则B处于第二周期,C、D、E处于第三周期,D的周期序数等于D原子最外层电子数,则D为Al,E原子半径是同周期中最小的(除稀有气体外),可以知道E为Cl,而C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2;
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故原子半径:O<N<Cl<Al<Na;
(2)D的最高价氧化物为氧化铝,属于两性氧化物,因此,本题正确答案是:两性;
(3)乙是Na2O2,含有离子键、共价键;
(3)乙是Na2O2,电子式为![]() ;
;
(4)C与D的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,两者反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】以甲醛和苯酚为主要原料,经如图所示系列转化可合成酚醛树脂和重要有机合成 中间体 D(部分反应条件和产物略去):
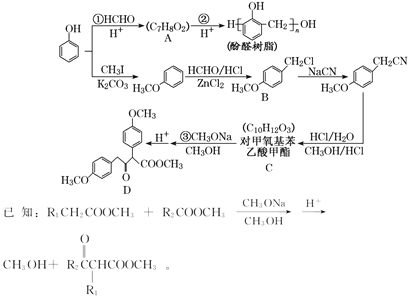
(1)CH3OH 的名称为_____。
(2)C 中所含官能团的名称是_____。
(3)反应②的化学方程式是_____。
(4)下列关于 A 的性质,能反映支链对苯环结构产生影响的是_____(填字母)。
a.能与氢氧化钠溶液反应 b.能使酸性高锰酸钾溶液褪色 c.稀溶液中加浓溴水产生沉淀
(5)E(C8H10O2)与 B 的水解产物互为同分异构体,1 mol E 可与 2 mol NaOH 反应,其核磁共振氢谱显示有 3 种峰且峰面积之比为 3∶1∶1,符合条件的 E 共有_____种。
(6) 完成下面以 CH3OH 和 CH3ONa 为 原 料 ( 其 他 无 机 试 剂 任 选 ) 制 备 化 合 物CH3COCH2COOCH3 的合成路线。 CH3OH――△→… ___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求,回答下列问题。
(1)选择下面的实验装置能完成相应的实验:
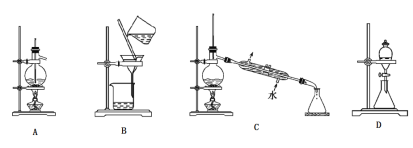
实验室制取乙烯到的装置是_____(填写序号,下同);分离苯和甲苯的装置是_________;提纯苯甲酸过程中进行分离操作用到的装置是_________;用CCl4萃取溴水中的溴用到的装置是_________。
(2)以下是五种常见有机物分子模型示意图,其中A、B、C为烃, D、E为烃的含氧衍生物。

鉴别A和B的试剂为__________;上述物质中有毒、有特殊气味,且不溶于水、密度比水小的液体是__________(填名称);D分子中的官能团是________;鉴别E的试剂可以选用______________。
(3)写出下列化学方程式:
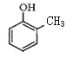 与足量溴水反应_____________________________________________;
与足量溴水反应_____________________________________________;
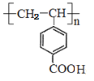 与足量NaOH溶液反应_______________________________。
与足量NaOH溶液反应_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上___ (填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上____ (填“有”或“没有”)气泡产生。
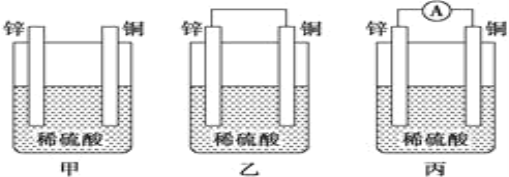
(2)乙、丙装置是将_____能转化为____能的装置,人们把它叫做________。
Ⅱ.将质量相等的锌片和铜片用导线相连,并浸入500 mL硫酸铜溶液中构成如图所示的装置。

(1)该装置中总反应的离子方程式为____________,铜片周围溶液会出现_________的现象。
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+2Y(g)![]() Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )
Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )

A. 若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度小于0.125mol/L
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,平衡常数K=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是一种挥发油,可从植物果实中提取,具有抗菌、解痉、镇静的作用,其结构简式为CH2=CH-CH2![]() OH。
OH。
(1)胡椒酚的分子式是_______。
(2)胡椒酚所含官能团的名称是_______、_______。
(3)胡椒酚与NaOH溶液反应的化学方程式是_______。
(4)1 mol胡椒酚与H2发生加成反应,理论上最多消耗_______ mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,易水解,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因__________。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是___________。
(3)用如图装置制备CrCl3时,主要步骤包括:
①将产物收集到蒸发皿中;
②加热反应管至400℃,开始向三颈烧瓶中通入氮气,继续升温到650℃;
③三颈烧瓶中装入150mL CCl4,并加热CCl4,温度控制在50~60℃之间;
④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;
⑤停止加热CCl4,继续通入氮气;
⑥检查装置气密性。
正确的顺序为:__________________________。

(4)用如图装置制备CrCl3时,向三颈烧瓶中通入N2的作用为_______________________________
(5)制备CrC13时生成的气体COCl2(俗称光气)有毒,COCl2遇水发生水解,反应方程式为COCl2+H2O═CO2↑+CHCl,为了防止污染环境,用NaOH溶液吸吸收光气,其化学方程式为____________________________________________________________。
(6)仔细分析整套装置,为了制取并收集到纯净的CrCl3,明显有一个不足之处,你认为应该改进的一项措施是__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如下图所示(部分产物已略去)

(1)若A是地売中含量最多的金属元素,将A的氯化物溶液和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则A的该氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为____________。
(2)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如图所示:则A与B溶液反应后溶液中的溶质为___________(填化学式),物质的量之比为_______。

(3)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com