
条件一定时,反应2A(g)+B(g) 2C(g),B的转化率α与温度T变化关系曲线图如下所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是
2C(g),B的转化率α与温度T变化关系曲线图如下所示,图中4个点中,表示未达到平衡状态,且V正<V逆的点是

A.a B.b C.c D.d
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A、16g O2中含有的氧分子数为NA
B、1mol Zn变为Zn2+时失去的电子数目为NA
C、常温常压下,11.2 L H2中含有的氢分子数为0.5NA
D、1L 1 mol·L-1 BaCl2溶液中含有的钡离子数为NA
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:实验题
(16分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
II.【制备产品】
实验装置如图所示(省略夹持装置):
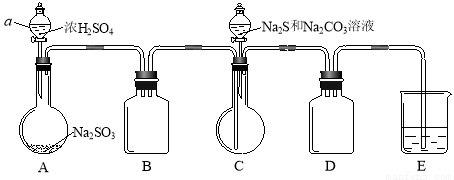
实验步骤:
(1)检查装置气密性,按图示加入试剂。
仪器a的名称是 ;E中的试剂是 (选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4。
(3)等Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液 (填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
III.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,
,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是
。
(3)Na2S2O3·5H2O的溶液度随温度升高显著增大,所得产品通过 方法提纯。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
所选试剂为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.78g苯含有C=C双键的数目为3NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
D.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:填空题
(16分)化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因 、 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g) ΔH>0,该设想能否实现? (选填“能”或“不能”),依据是 。
(2)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的离子方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度 (选填“增大”、“减小”或“不变”)。
(3)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向 (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
在恒温时,一固定容积的容器内发生反应:PCl5(g)  PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度
PCl3 (g)+Cl2(g)。达到平衡时,再向容器内通入一定量PCl5 (g),重新达到平衡后,与第一次平衡时相比,Cl2的浓度
A.增大 B.减小 C.不变 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(12分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的实验流程图:
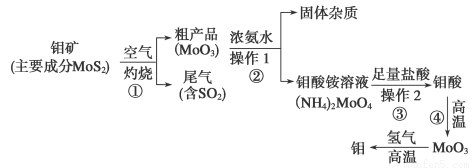
(1)钼酸铵溶液中阳离子的检验方法:________________________________________。
(2)写出反应①的化学方程式:______________________________________________。
(3)反应①的尾气可以用NH3·H2O溶液吸收用于合成肥料,写出反应的离子方程式
______________________________________________________________________。
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O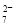 ,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
①H2O2的作用是将溶液中的Cr3+转化为Cr2O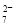 ,写出此反应的离子方程式:______________。
,写出此反应的离子方程式:______________。
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
加入NaOH溶液使溶液呈碱性,Cr2O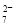 转化为CrO
转化为CrO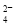 。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
③写出上述过程中用SO2作还原剂进行还原的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作致冷剂 C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数的数值,下列说法中正确的是
A.常温常压下,在空气中燃烧0.l molH2,转移的电子总数为0.2 NA
B.常温常压下,2.24 L NO和NO2混合气体中含有的氮原子数目为0.lNA
C.1.0 L的0.1 mol·L-lNa2S溶液中含有的S2-离子数为0.1 NA
D.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com