
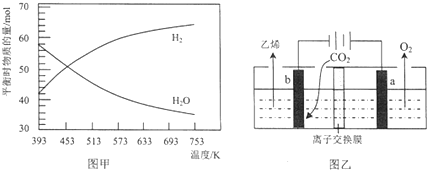
分析 (1)根据盖斯定律,热化学方程式Ⅱ×2-热化学方程式Ⅰ可得热化学方程式Ⅲ,从而得出目标反应Ⅲ的焓变△H3;
(2)①由图甲可知温度升高氢气的浓度增加,水蒸气的浓度减小,所以平衡逆向移动,由此分析;
②A.使用催化剂,可降低反应活化能,加快反应速率;
B.其它条件不变时,若扩大容器容积,则U正减小,v逆减小;
C.测得容器内混合气体密度一直不随时间改变而改变;
③根据三行式求平衡时各物质的量,然后根据转化率等于$\frac{变化量}{初始量}×100%$;
④393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,相当于增大压强,平衡正向移动;
⑤电解时,二氧化碳在b极上得电子发生还原反应生成乙烯;
⑥离子交换只允许氢离子通过,所以是阳离子交换膜.
解答 解:(1)反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)═(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)═NH4HCO3(aq)△H2
根据盖斯定律Ⅱ×2-Ⅰ可得:(NH4)2CO3(aq)+H2O (l)+CO2(g)?2NH4HCO3(aq)△H3=2△H2-△H1,所以K3=$\frac{{K}_{2}^{2}}{{K}_{1}}$,
故答案为:$\frac{{K}_{2}^{2}}{{K}_{1}}$;
(2)①由图甲可知温度升高氢气的浓度增加,水蒸气的浓度减小,所以平衡逆向移动,所以正反应是放热,所以a<0,故答案为:<;
②A.使用催化剂,可降低反应活化能,加快反应速率,故正确;
B.其它条件不变时,若扩大容器容积,则U正减小,v逆减小,故错误;
C.测得容器内混合气体密度一直不随时间改变而改变,所以不一定平衡,故错误;
故选A;
③2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)
初起:a 3a 0 0
变化:29 3a-42=87 14.5 58
平衡:a-29 42 14.5 58
所以a=43,转化率=$\frac{变化量}{初始量}×100%$=$\frac{29}{43}$×100%=67.4%,
故答案为:67.4%;
④393K下,该反应达到平衡后,再向容器中按n(CO2):n(H2)=1:3投入CO2和H2,相当于增大压强,平衡正向移动,所以则n(H2)/n(C2H4)将变小,
故答案为:变小;
⑤电解时,二氧化碳在b极上得电子发生还原反应生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故答案为:2CO2+12H++12e-=C2H4+4H2O;
⑥离子交换只允许氢离子通过,所以是阳离子交换膜,故答案为:阳.
点评 本题为综合题,考查热化学方程式书写方法和盖斯定律的计算应用,化学平衡常数、反应速率的影响因素分析,明确化学平衡相关规律、清楚图象含义是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷是烃类物质中氢的质量分数最高的化合物 | |
| C. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 | |
| D. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能使溴的四氯化碳溶液褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 不能发生加成反应 | D. | 属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅黄色 | |
| B. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| C. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 | |
| D. | 该溶液中加入NaOH溶液,生成白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com