
【题目】下列反应式正确的是
A. 铅蓄电池充电时阴极的反应式:Pb2++2e-=Pb
B. 碱性锌锰干电池放电时,负极反应式:Zn-2e-=Zn2+
C. 酸性高锰酸钾与草酸溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑-8H2O
D. I用铁氰化钾检验Fe2+:3FeCl2+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+6KCl
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是___________。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
② | 在FeCl2溶液中加入锌片 |
| Zn+Fe2+=Zn2++Fe | |
③ | 在FeCl3溶液中加入足量铁粉 |
| Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
④ |
|
| Fe3+具有氧化性 |
实验结论:_________________________________。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:_____。(填序号)
A、Cl2 B、Na C、Na+ D、Cl- E、SO2 F、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的实验方法正确的是
A. 除去乙酸乙酯中的少量乙酸:加入KOH溶液,充分反应后,弃去水溶液
B. 除去苯酚中的少量甲苯:加入酸性高锰酸钾溶液,充分反应后,弃去水溶液
C. 除去苯中少量的甲苯:加高锰酸钾溶液,振荡,分液
D. 除去乙醇中少量的水:加足量生石灰,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物P是某抗病毒药物的中间体,它的一种合成路线如下。
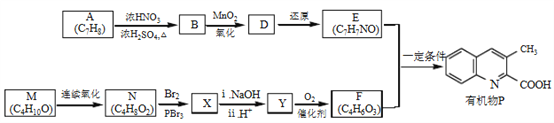
已知:

(1)A为芳香化合物,其结构简式是________________________________________
(2)A→B的化学方程式是,_____________________反应类型是_____________________________________
(3)M无支链,N中含有的官能团是_________________________________
(4)M连续氧化的步骤如下:
![]()
M转化为Q的化学方程式是________________________________。
(5)X的分子式是C4H7O2Br。下列说法正确的是(_______)
a.F能发生酯化反应和消去反应
b.Y在一定条件下可生成高分子化合物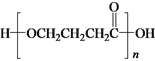
c.1 molX与NaOH溶液反应时,最多消耗2mol NaOH
(6)E的结构简式是_____________________________________
(7)以乙烯为起始原料,选用必要的无机试剂合成M,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治环境污染,改善生态环境已成为全球的共识。
(1)向煤中加入石灰石作为脱硫剂,可以减少燃烧产物SO2的排放,生成CaSO4。写出SO2减少的化学方程式:___________________________________________。
(2)煤的气化和液化是高效、清洁利用煤炭的重要途径。将焦炭在高温下与水蒸气反应,得到CO和H2,发生该反应的化学方程式为:_______________________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成CO2和N2,该反应的化学方程式为:___________________________________。
(4)天然水中杂质较多,常需加入明矾、漂白粉等物质处理后才能饮用。其中漂白粉的作用是杀菌消毒,其作用原理可用化学方程式表示为:_________________________。
(5)处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+,再用氨水将Cr3+转变为难溶的Cr(OH)3,在该过程中氧化剂为______________,其中氨水转化Cr3+为Cr(OH)3的离子方程式为____________________________________________;该方案处理后的废水中因含有大量________元素,直接排放会导致水体富营养化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验
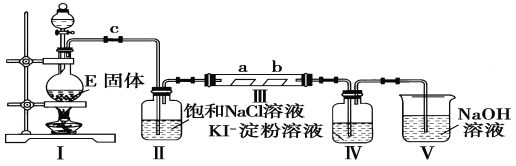
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式为_______________。
(2)装置Ⅱ的作用是____________________________________。
(3)实验过程中,装置Ⅳ中的实验现象为_________________________;发生反应的化学方程式为_______________________________。
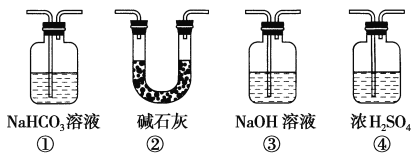
(4)实验结束后,该组同学在装置Ⅲ中(a是干燥的品红试纸,b是潮湿的品红试纸)观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置_______与_____________之间添加下图中的_____________装置(填序号),该装置的作用是____________。
(5)装置V的目的是防止尾气污染空气,写出装置V中发生反应的化学方程式:_________________。
(6)将8.7 g MnO2与含HCl 14.6 g的浓盐酸共热制Cl2,甲同学认为可制得Cl2 7.1 g,乙同学认为制得Cl2的质量小于7.1 g,你认为__________(填“甲”或“乙”)同学正确,原因是 ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①溶液都是纯净物 ②含氧的化合物都是氧化物 ③能电离出H+的化合物都是酸 ④能电离出OH-的化合物都是碱 ⑤能电离出金属离子和酸根离子的化合物都是盐 ⑥酸和碱的中和反应都是复分解反应
A.全部
B.⑤⑥
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2S2O8具有强氧化性(S2O82-中含有过氧根),在石油行业中有重要用途,工业上可利用电解法制备它,工作原理如图(电极材料是石墨)所示,下列说法中错误的是
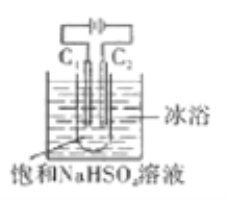
A. C1电极上的电极反应式为:2SO42--2e-=S2O82-
B. 通电后Na+移向C2电极
C. 反应一段时间后,溶液的pH减小
D. 电解过程中,两电极上参与反应的离子的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com