
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 化学反应速率的单位由时间单位和物质的量单位决定 | |
| C. | 离子键的本质是静电作用,只能存在于由阴,阳离子构成的物质中 | |
| D. | 可将金属钠在研体中研成粉末,使钠与水反应的实验更安全 |
分析 A、铝表面生成一层致密的氧化物保护膜,阻止内部金属继续被氧化;
B、化学反应速率通常用单位时间内反应物或生成物的物质的量浓度的变化来表示;
C、离子键是阳离子、阴离子之间的静电作用,既有吸引又有排斥作用;
D、根据金属钠的性质来分析.
解答 解:A、铝表面生成一层致密的氧化物保护膜,阻止内部金属继续被氧化,铝是活泼金属,故A错误;
B、化学反应速率通常用单位时间内反应物或生成物的物质的量浓度的变化来表示,故B错误;
C、离子键是阳离子、阴离子之间的静电作用,只能存在于由阴、阳离子构成的物质中,故C正确;
D、金属钠性质比较活泼,在研钵中研成粉末时易于空气中氧气,水反应,故D错误.
故选C.
点评 本题考查铝的活泼性、化学反应速率、离子键的存在和常见的实验基本操作知识,可以根据教材知识来回答,较简单.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
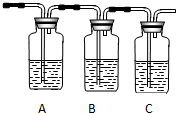 品红溶液 KMnO4 溶液品红溶液 品红溶液 KMnO4 溶液品红溶液 ① |  ② ② | 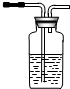 ③ | 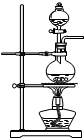 ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
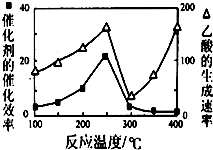 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
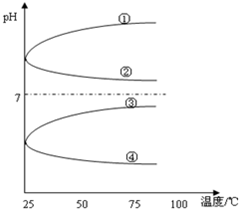 A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com