
分析 因废液中含有Fe3+,滴加NaOH调节溶液pH时会生成Fe(OH)3红褐色沉淀,达到除去溶液里Fe3+的目的,然后加入亚硫酸钠溶液将溶液里的将+6价的Cr还原为+3价,然后将Cr3+转化为Cr(OH)3沉淀,再通过氧化和酸化两个过程即得到目标产物,最后利用滴定法测定产品的纯度,
(1)根据沉淀的颜色判断;
(2)Na2SO3具有还原性,具有氧化性Na2Cr2O7;
(3)Cr(OH)3与H2O2反应生成生成CrO42-;
(4)酸性条件下CrO42-转化为Cr2O72-;
(5)Fe2+使Cr2O72-完全转化为Cr3+,反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,根据方程式计算出的K2Cr2O7物质的量和质量,再求出纯度.
解答 解:(1)用NaOH溶液调pH至3.6,产生红褐色沉淀,则该沉淀为Fe(OH)3,故答案为:Fe(OH)3;
(2)Na2SO3具有还原性,具有氧化性Na2Cr2O7,向滤液中加入Na2SO3,发生氧化还原反应,将+6价的Cr还原为+3价,
故答案为:将Cr2O72-还原为Cr3+;
(3)在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,Cr(OH)3与H2O2反应生成生成CrO42-,反应的离子方程式为:2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O;
故答案为:2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O;
(4)向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体,在酸性条件下CrO42-转化为Cr2O72-,说明A为酸,则A可以是硫酸,故选c;
故答案为:c;
(5)Fe2+使Cr2O72-完全转化为Cr3+,反应为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,已知18.00mL 0.50mol/L的FeSO4溶液,
则K2Cr2O7物质的量为:$\frac{1}{6}$×0.018L×0.50mol/L=0.0015mol,其质量为0.0015mol×294g/mol=0.441g,
其纯度为$\frac{0.441g}{0.45g}$×100%=98%;
故答案为:98%.
点评 本题综合考查物质的制备,为高频考点和常见题型,题目涉及氧化还原反应、离子方程式的书写、根据方程式的计算、化学平衡移动等问题,题目难度中等,本题注意从质量守恒的角度利用关系式法计算,难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:实验题
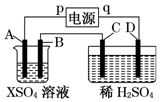 如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:
如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
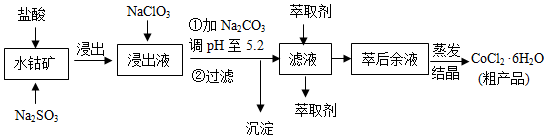
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
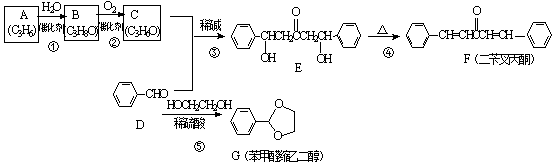
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是 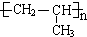 .
.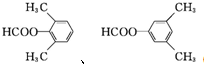 .
.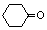 (环已酮)合成
(环已酮)合成 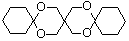 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]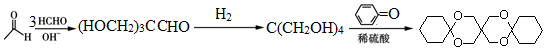 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
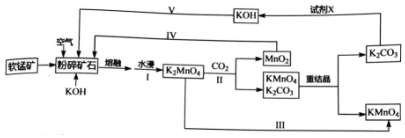
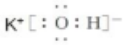 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
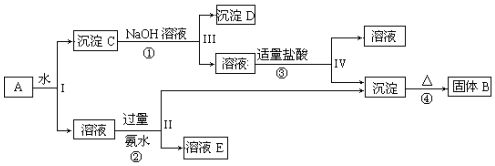
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
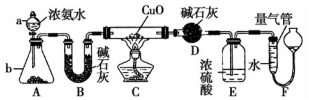 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
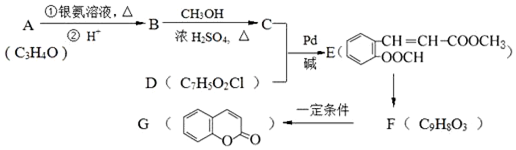

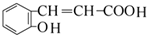 .
.
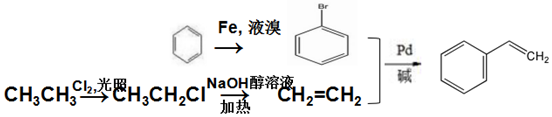 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com