
完成下列离子方程式
(1)用食醋清除水垢(主要成分是CaCO3):
(2)含有氢氧化铝的胃药能降低胃酸:
(3)用惰性电极电解饱和氯化钠溶液:
(4)向硫酸氢钠溶液中加氢氧化钡溶液至恰好沉淀:
(1)CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
(2)Al(OH)3+3H +=Al3++3H2O;
(3)2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-;
H2↑ + Cl2↑ + 2OH-;
(4)Ba2+ + OH- + H+ + SO42-====BaSO4↓+ H2O。
【解析】
试题分析:(1)醋酸与CaCO3反应生成醋酸钙、水和二氧化碳,离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;(2)胃酸的主要成分为盐酸,盐酸与氢氧化铝反应生成氯化铝和水,离子方程式为:Al(OH)3+3H +=Al3++3H2O;(3)用惰性电极电解饱和氯化钠溶液生成氢氧化钠、氢气和氯气,离子方程式为:2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-;(4)向硫酸氢钠溶液中加氢氧化钡溶液至恰好沉淀生成硫酸钡、水和氢氧化钠,离子方程式为:Ba2+ + OH- + H+ + SO42-====BaSO4↓+ H2O。
H2↑ + Cl2↑ + 2OH-;(4)向硫酸氢钠溶液中加氢氧化钡溶液至恰好沉淀生成硫酸钡、水和氢氧化钠,离子方程式为:Ba2+ + OH- + H+ + SO42-====BaSO4↓+ H2O。
考点:考查离子方程式的书写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届吉林省公主岭市高三上学期第二次月考化学试卷(解析版) 题型:选择题
由钠、镁、铝、锌四种金属单质中的两种组成的合金共12g,跟足量的盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是( )
A.Na B.Mg C.Al D.Zn
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:填空题
某溶液中可能存在Al3+、Cl-、Mg2+、Na+ 、 Br-、CO32-、SO32-等七种离子中的几种。现取该溶液进行实验,得到如下现象:
①向该溶液中滴加足量氯水后有无色无味气体产生,再加入CCl4振荡,下层液体呈红棕色;
②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀产生;
③向所得溶液中继续滴加AgNO3溶液,有不溶于HNO3的白色沉淀产生。
据此可以推断,该溶液中肯定存在的离子是_____________,可能存在的离子是 ________。
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Z>Y
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
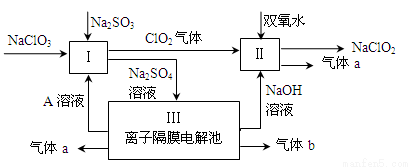
(1)Ⅰ中发生反应的还原剂是 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,气体b的化学式是 ,装置Ⅲ中发生反应的化学方程式是 。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑ + 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是 。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列各组在溶液中的反应,无论反应物的量多少,都能用同一离子方程式表示的是
A.Ba(OH)2与H2SO4 B.FeBr2与Cl2
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.金属单质与盐溶液的反应都是置换反应
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3属于化合反应
C.SO2+Cl2+2H2O=2HCl+H2SO4属于氧化还原反应
D.AgNO3+HCl=AgCl↓+HNO3该反应不能说明盐酸酸性比硝酸强
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:填空题
(8分)工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去。下图为电解装置示意图(电极材料分别为铁和石墨):
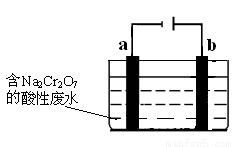
请回答:
(1)装置中的b电极是 (填“阳极”或“阴极”)。
(2)a电极的电极反应式是 。
(3)完成b电极附近溶液中反应的离子方程式:
Cr2O72-+6Fe2++14H+=2 +6 +7
(4)电解时用铁不用石墨做阳极的原因是 。
(5)电解结束后,若要检验电解液中还有Fe2+存在,可选用的试剂是 (填字母)。
A.KSCN溶液 B.CuCl2溶液 C.H2O2溶液 D.K3[Fe(CN)6]
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol
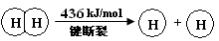

下列说法不正确的是
A.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固
B.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol
C.破坏1 mol H—O 键需要的能量是463.4 kJ
D.H2(g) + 1/2O2(g)=H2O(l) ΔH <-241.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com