
【题目】水稻可从土壤中吸收NH4+,其中的N元素可用来合成
A. 淀粉和纤维素 B. 蛋白质和核酸 C. 脂肪和DNA D. 麦芽糖和磷脂
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
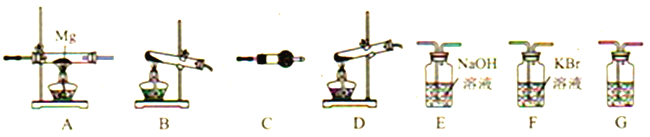
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据: Fe(s)+ ![]() O2(g)═FeO(s)△H=﹣272kJmol﹣1
O2(g)═FeO(s)△H=﹣272kJmol﹣1
2Al(s)+ ![]() O2(g)═Al2O3(s)△H=﹣1675kJmol﹣1
O2(g)═Al2O3(s)△H=﹣1675kJmol﹣1
则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
A.+859 kJmol﹣1
B.﹣859 kJmol﹣1
C.﹣1403 kJmol﹣1
D.﹣2491 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ,
(4)在B、C、E、F、G、H中,原子半径最大的是 ,
(5)A和D组成化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程 ,
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]某硅酸盐研究所在硅酸盐材料和闪烁晶体等领域研究上取得了重大的成就。
(1)SiO44-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子排布图是________。
②与SiO44-互为等电子体的微粒符号是______(任写一种)。
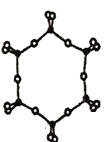
③下图为一种硅氧组群的结构示意图,其离子符号为______,其中Si原子的杂化方式为____。
④电负性:Si______O(填“>”、“=”或“<”) 。
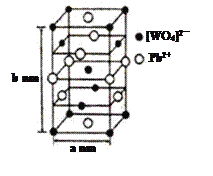
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
①PWO中钨酸根结构式式为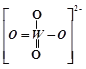 ,该离子中δ键和π键的个数比是______。
,该离子中δ键和π键的个数比是______。
②PWO晶体中含有的微粒间作用力是______(填标号)。
A.范德华力 B.离子键
C.共价键 D.金属键
③己知晶体的摩尔质量为Mg·mol-1,则该晶体的密度d=_______g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E5种微粒,它们可能是原子或离子,并且组成它们的元素的原子序数都小于18。A微粒的最外层电子数比次外层多5个;金属原子B的原子核内质子数比前一周期的同族元素多8个,其单质不能从CuSO4溶液中置换出Cu;C元素有3种同位素:C1、C2、C3,C1的质量数分别为C2、C3的![]() 和
和![]() ;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
;D元素的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有2个原子核10个电子,E极易与C+结合成中性微粒。
(1)写出五种微粒的表示符号:A________、B________、C________、D________、E________。
(2)写出C的同位素名称:C1________、C2________、C3________。
(3)C和D形成的10个电子的分子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石墨烯是烃类,属于分子晶体
B. 苯的结构特殊,分子中既没有单键也没有双键
C. 邻二甲苯只有一种结构,说明苯中所有碳碳键相同
D. 石油的分馏和煤的液化都是发生了物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2C1的电子式______________________。
(2)写出NH2C1与水反应的化学方程式______________________。
(3)一定条件下(T℃、1.01×105Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:

写出该反应的热化学方程式____________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
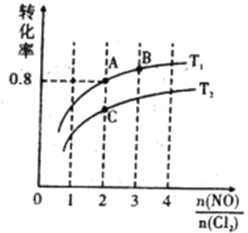
(4)图中T1、T2的关系为:T1______T2 (填“>”、“<”或“=”)
(5)图中纵坐标为物质__________的转化率,理由为___________________________。
(6)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”、“B”、或“C”)。
(7)若容器容积为1L,则B点的平衡常数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com