
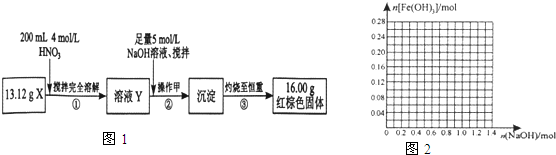
| 阳离子 | 阳离子浓度(mol/L) |
| H+ | 0.5 |
| 16g |
| 160g/mol |
| 0.896L |
| 22.4L/mol |
| 16g |
| 160g/mol |
| 0.896L |
| 22.4L/mol |
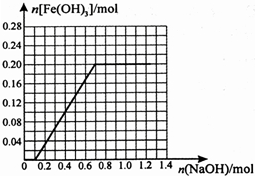 ,
, .
.

科目:高中化学 来源: 题型:
| 5 |
| 8 |
| 5 |
| 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
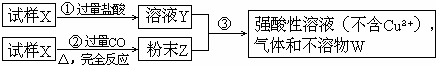
由MgO、A12O3、SiO2、Fe2O3组成的混合粉末。现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y。下列叙述正确的是
A.从组成看,其成分皆是碱性氧化物
B.溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+
C.沉淀X的成分是SiO2
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
由MgO、A12O3、SiO2、Fe2O3组成的混合粉末。现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y。下列叙述正确的是( )
A.从组成看,其成分皆是碱性氧化物
B.溶液Y中的阳离子主要是Mg2+、Al3+、Fe2+、H+
C.沉淀X的成分是SiO2
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com