解:(1)40gSO
3气体物质的量为0.5mol,生成液态硫酸放出65.15kJ,
则1molSO
3气体被水完全吸收生成液态硫酸放出130.3kJ热量,
热化学方程式为:SO
3(g)+H
2O(l)=H
2SO
4(l)△H=-130.3kJ/mol,
故答案为:SO
3(g)+H
2O(l)=H
2SO
4(l)△H=-130.3kJ/mol;
(2)①化学平衡常数的大小可以表示反应进行的程度.化学平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应则相反.根据表中数据可知:随温度升高平衡常数减小,说明正反应为放热反应,放热反应△H<0,
故SO
2(g)+

O
2(g)

SO
3(g)△H=a kJ?mol
-1 反应中a<0,为负值.
故答案为:<;
②A.化学平衡常数的大小可以表示反应进行的程度.K值越大,表明反应进行的程度越大,而反应进行的程度越大,并不意味SO
2的转化率一定越高,故A不正确;
B.K值越大,表明反应进行的程度越大,而反应进行的程度越大,并不意味SO
3的产量一定越大,产量还取决与反应物的投料量等因素.故B不正确;
C.化学平衡常数的大小可以表示反应进行的程度.K值越大,表明反应进行的程度越大,正反应进行得越完全.故C正确;
D.化学平衡常数的大小可以表示反应进行的程度.不表示反应的快慢,与化学反应速率无关.故D不正确;
故答案为:C;
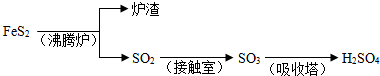
(3)A.Fe
2O
3 与CO反应需要高温,消耗大量能量,然后Fe与浓硫酸反应时有二氧化硫放出,污染环境,不符合绿色化学理念.故A不正确;
B.Fe
2O
3 +3H
2SO
4 ═Fe
2(SO
4)
3 +3H
2O,Fe
2(SO
4)
3 +Fe═3FeSO
4,反应中无污染物产生,最能体现绿色化学理念的方案.故B正确;
C.Fe与浓硫酸反应时有二氧化硫放出,污染环境,不符合绿色化学理念.故C不正确;
故答案为:B;
(4)
| 实验序号 | 催化剂颗粒大小 | 温度(K) | 压强(KPa) |
| 1 | 粗颗粒 | 673 | 101Kpa增大到1010Kpa |
| 2 | 细颗粒 | 673 | 101Kpa增大到1010Kpa |
| 3 | 粗颗粒 | 673K增大到723K | 101Kpa |
| 4 | 细颗粒 | 673K增大到723K | 101Kpa |
第一组和第二组保持温度不变,逐步增大压强,对比催化剂粗颗粒与细颗粒对反应速率的影响,
第三组和第四组保持压强不变,逐步升高温度,对比催化剂粗颗粒与细颗粒对反应速率的影响,
所以通过变换这些实验条件,至少需要完成4个实验然后进行对比才能得出结论,
故答案为:4;
(5)设可制得石膏物质的量为x,
22.4m
3(标准状况下)的尾气物质的量为:
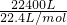
=1000mol,
尾气中SO
2的体积分数为0.200%,得SO
2物质的量为:1000mol×0.200%=2mol,二氧化硫的利用率为80.0%,
反应方程式为:CaCO
3+SO
2+H
2O═CaSO
3+CO
2↑+H
2O、2CaSO
3+O
2+4H
2O═2CaSO
4?2H
2O,
根据硫元素守恒得:SO
2 ~CaSO
4?2H
2O
1mol 1mol
2mol×80.0% x
解得:x=1.6mol,
则石膏的质量为:1.6mol×172g/mol=275.2g≈0.28Kg,
故答案为:0.28;
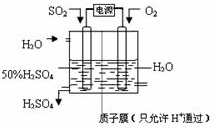
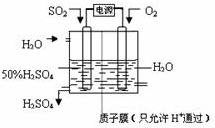
(6)电解池中阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应.根据题意可知:通入二氧化硫的电极为阳极,通入氧气的电极为阴极,阳极反应:SO
2+2H
2O-2e
-=SO
42-+4H
+,阴极反应:O
2+4H
++4e
-═2H
2O,阴、阳电极反应合并得总反应为:2SO
2+O
2+2H
2O=2H
2SO
4.
故答案为:SO
2+2H
2O-2e
-=SO
42-+4H
+、2SO
2+O
2+2H
2O=2H
2SO
4.
分析:(1)热化学方程式书写要求标明各物质的状态、热量用△H表示、放热用符号“-”、吸热用符号“+”、单位为kJ/mol,各物质前的计量数表示物质的量,注意热量随着计量数而改变;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数;
化学平衡常数表示反应进行的程度.化学平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应则相反;
(3)绿色化学是指设计没有或者只有尽可能小的环境负作用并且在技术上和经济上可行的化学品和化学过程.它是实现污染预防的基本的和重要的科学手段;
(4)反应速率的影响条件有浓度、压强、温度、催化剂、反应物颗粒大小等.抓住温度一定时改变压强或压强一定时改变温度去进行对比实验研究反应速率;
(5)根据题意,紧抓硫元素守恒分析解题;
(6)电解原理:使电流通过电解质溶液,而在阴、阳两极引起氧化还原反应的过程.阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应.分析出氧化剂、还原剂,结合电解质溶液,正确书写出电极反应.
点评:本题涉及电解法制硫酸很有新意,能够加深对电解原理的理解,同时涉及到化学平衡常数K、化学平衡常数的影响条件、热化学方程式、绿色化学理念、反应速率的影响条件比较、电化学原理等广泛内容,需要对知识的全面掌握,难度较大.


 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1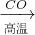 Fe
Fe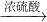 FeSO4;B.Fe2O3
FeSO4;B.Fe2O3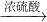 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3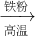 Fe
Fe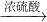 FeSO4
FeSO4
 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1 反应中a<0,为负值.
SO3(g)△H=a kJ?mol-1 反应中a<0,为负值.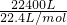 =1000mol,
=1000mol,

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案

 O2(g)
O2(g) SO3(g)△H=a kJ?mol-1 下表为不同温度(T)下该反应的化学平衡常数(K):
SO3(g)△H=a kJ?mol-1 下表为不同温度(T)下该反应的化学平衡常数(K):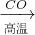 Fe
Fe FeSO4
FeSO4 Fe2(SO4)3
Fe2(SO4)3 FeSO
FeSO 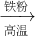 Fe
Fe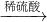 FeSO4
FeSO4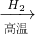 Fe
Fe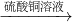 FeSO4
FeSO4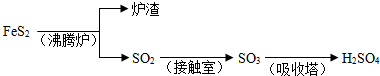

 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1 Fe
Fe FeSO4;B.Fe2O3
FeSO4;B.Fe2O3 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3 Fe
Fe FeSO4
FeSO4