
| A. | 氢氧化铁 | B. | 金属铝 | C. | 氧化铝 | D. | 硫酸铜 |
分析 中学常见的既能与酸反应又能与碱反应的物质主要有:Al、两性氧化物、两性氢氧化物、多元弱酸的酸式盐、弱酸的铵盐、氨基酸、蛋白质等,注意产物为盐与水,注意Al为单质.
解答 解:A.氢氧化铁与硫酸反应生成硫酸铁与水,不能与氢氧化钠溶液反应,故A错误;
B.Al与硫酸酸生成硫酸铝与氢气,与氢氧化钠溶液反应生成偏铝酸钠与氢气,但Al是单质,不属于化合物,故B错误;
C.氧化铝属于两性氧化物,与硫酸反应生成硫酸铝由水,与氢氧化钠溶液反应生成偏铝酸钠与水,故C正确;
D.硫酸铜与氢氧化钠溶液反应生成氢氧化铜与硫酸钠,但不能与硫酸反应,故D错误,
故选:C.
点评 本题考查元素化合物的性质,比较基础,注意基础知识的积累与归纳总结.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2-CH3 | B. | CH2=CH2 | C. | CH3-CH=CH-CH3 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 的系统命名4-甲基-2-乙基-1-戊烯.
的系统命名4-甲基-2-乙基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
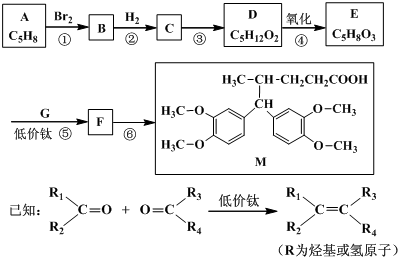
 (其中之一);.
(其中之一);. 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,每消耗2mol NO2,就会生成22.4L N20 | |
| B. | N20有氧化性,且为HN02的酸酐 | |
| C. | 等质量的N20和C02含有相等的电子数 | |
| D. | N20会迅速与人体血红蛋白结合,使人中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可利用以下方法测定铝镁合金(不含其它元素)组分含量
可利用以下方法测定铝镁合金(不含其它元素)组分含量查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3-H2O=Cu(OH)2↓+2NH4+ | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2 H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶Ca(ClO)2液中通入少量SO2:Ca2++3ClO-+SO2 +H2O═CaSO4 ↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2 溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═A l(OH)3 ↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL 2mol/LFeBr2 的溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2 ═2Fe3++4Br2 +10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2 +2H+═Fe2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com