
分析 根据反应Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量,由此分析解答;
解答 解:(1)若所用药品无水亚硫酸钠固体没有变质,由硫守恒可得:Na2SO3~SO2,因此需亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{1.12L}{22.4L/mol}$=6.3g,答:至少需要称取亚硫酸钠的质量为6.3g;
(2)如果已有30%亚硫酸钠(质量分数),被氧化成硫酸钠,则含亚硫酸钠的质量分数为70%,
至少需称取该亚硫酸钠的质量为$\frac{6.3g}{70%}$=9.0g,
答:少需称取该亚硫酸钠的质量为9.0g.
点评 本题考查化学反应方程式的计算,为高频考点,题目难度不大,学生只要根据反应方程式列已知物与未物之间的关系就可以迅速解题了.


科目:高中化学 来源: 题型:选择题
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol•L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
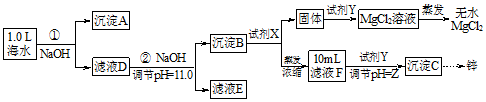
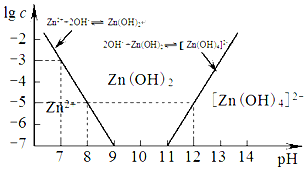
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaH2+2H2O═Ca(OH)2+2H2↑ | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | 2Na2O2+H2O═4NaOH+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
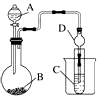 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
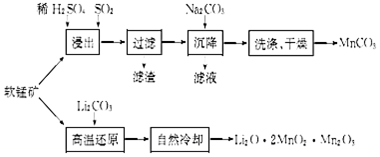
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com