
下列物质的转化在给定条件下不能实现的是( )

A.①②③ B.②③④ C.②③⑤ D.①④⑤
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:填空题
H是一种人工合成的香料,其合成路线可简单表示如下:
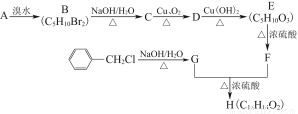
已知A的结构简式为CCH3—CH2CH3CH2,F的分子结构中含有2个甲基。
请回答下列问题:
(1)C中官能团的名称为 ,G的核磁共振氢谱中有 组峰,H的结构简式为 。
(2)写出反应D→E的化学方程式: 。
E在一定条件下生成的高分子化合物的结构简式为 _ _。
(3)写出符合下列条件的F的3种同分异构体的结构简式: 。
①属于酯类 ②含有1个甲基 ③能与溴水发生加成反应 ④能发生银镜反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
对于几种常见的有机物:甲烷、苯、乙醇、葡萄糖,下列有关说法错误的是( )
A.它们都能发生氧化反应,氧化产物可能相同也可能不同
B.甲烷、乙醇均可代替汽油作车用燃料,清洁环保
C.已知溴乙烷与NaOH的水溶液共热可生成乙醇,该反应属于取代反应
D.相同质量的苯、乙烷分别与氧气完全燃烧,前者耗氧量大
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
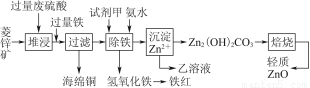
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.金属钠、钾在空气中易被氧化,应该在水中密封保存
B.某气体能使酸性KMnO4溶液褪色,该气体一定是SO2
C.Al(OH)3、NaHCO3和CaCO3均能用来治疗胃酸过多
D.为了延长钢闸门的使用寿命,可将其与电源正极相连
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:选择题
5种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是( )
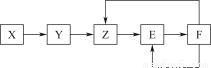
A.X可能是一种氢化物
B.M可能是金属
C.E是一种有色气体
D.X→Y可能是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2+bCl2+cC aTiCl4+cCO反应(1)
aTiCl4+cCO反应(1)
TiCl4+2Mg Ti+2MgCl2反应(2)
Ti+2MgCl2反应(2)
关于反应(1)、(2)的分析不正确的是( )
①TiCl4在反应(1)中是还原产物,在反应(2)中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应(1)、(2)中的还原性C>TiCl4,Mg>Ti;
④a=1,b=c=2;
⑤每生成19.2 g Ti(Mr=48),反应(1)、(2)中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:实验题
硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
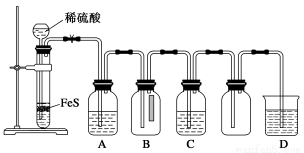
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 | 实验现象 |
实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。

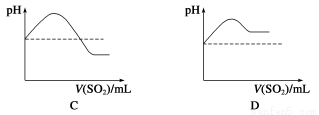
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com