
下列反应属于加成反应的是
A.2CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
B.
C.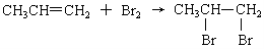
D.
 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1, ①
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1, ②
①热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
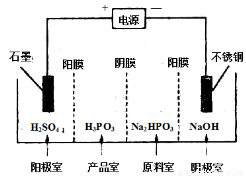
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:实验题
[实验化学]
对硝基苯甲酸在医药、感光材料等工业中应用广泛。以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242 ℃,沸点约359 ℃,微溶于水,能升华。)的反应原理为:
 +Na2Cr2O7+4H2SO4―→
+Na2Cr2O7+4H2SO4―→ +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O
某小组以对硝基甲苯等物质为原料制取对硝基苯甲酸的实验装置如下图所示(加热和仪器固定装置均已略去),实验步骤如下:

步骤1:向250 mL三颈烧瓶中依次加入适量的对硝基甲苯、重铬酸钠粉末、水,并充分混合。在搅拌下,用滴液漏斗滴入适量浓硫酸后,加热0.5 h至反应液呈黑色。
步骤2:待反应混合物冷却后,和适量冰水充分混合,抽滤并用50 mL水分两次洗涤。将洗涤后的固体放入盛有适量5%硫酸溶液中,水浴加热10 min,冷却后抽滤。
步骤3:将抽滤后的固体溶于适量5%NaOH溶液中,50 ℃温热后抽滤,在滤液中加入少量活性炭,煮沸后趁热抽滤。将得到的滤液慢慢加入到盛有适量15%硫酸溶液的烧杯中,析出黄色沉淀,抽滤,冷水洗涤,干燥得粗产品。
(1) 在步骤1中“搅拌”是用电动搅拌器完成的,这样操作的好处有________、________。
(2) 在三颈烧瓶中,随着浓硫酸的加入,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是________。
(3) 在步骤2中,抽滤所得固体的主要成分是________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4) 步骤3用NaOH溶液进行处理的作用主要是____。
用NaOH溶液处理后,需50 ℃温热后抽滤的原因是____。
(5) 制得的粗产品需要进一步精制(纯化),根据对硝基苯甲酸的有关性质可知,对其进行精制(纯化)可以用乙醇溶液完成,也可以采用________法完成。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
用下列装置进行相应实验,不能达到实验目的的是( )

A. 图1所示装置可制备氢氧化亚铁
B. 图2所示装置可电解食盐水制氯气和氢气
C. 图3所示装置可验证氨气极易溶于水
D. 图4所示装置与操作可除去苯中的苯酚
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.稀硝酸与氢氧化钾溶液反应H++OH-=H2O
B.铝与稀盐酸反应Al+2H+=Al3++H2↑
C.三氯化铁溶液与氢氧化钠溶液反应FeCl3+3OH-=Fe(OH)3↓+3Cl-
D.二氧化碳与石灰水反应CO2+2OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
下列物质互为同分异构体的一组是
A.35Cl和37ClB.CH3CH2OH和CH3OCH3
C.O2和O3 D.H2O和H2O2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)(1)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ki = 1.75×10-5
碳酸 Ki 1= 4.30×10-7 Ki 2 = 5.61×10-11
亚硫酸 Ki 1= 1.54×10-2 Ki 2 = 1.02×10-7
写出碳酸的第一级电离平衡常数表达式:Ki = _ __
在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性最强的是
③ 若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A. c(CH3COO-) B. c(H+) C. w醋酸电离平衡常数 D. 醋酸的电离度
 (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。
下列叙述不正确的是  w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KCl溶液,则无白色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。

设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
有关下列各组热化学方程式中关系说法正确的是
2H2(g)+O2(g)=2H2O(g); △H1 = -Q1kJ/mol
2H2(g)+O2(g)=2H2O(1); △H2 = -Q2kJ/mol
H2(g)+1/2O2(g)=H2O(1);△H3 = -Q3kJ/mol
A.△H1=△H2 B.△H1<△H2 C. Q1 >2Q3 D.△H1>2△H3
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下不能实现的是
A.Ca(ClO)2(aq)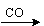 HClO(aq)
HClO(aq)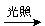 HCl(aq)
HCl(aq)
B.H2SiO3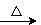 SiO2
SiO2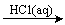 SiCl4
SiCl4
C.Al2O3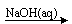 NaAlO2(aq)
NaAlO2(aq)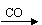 Al(OH)3
Al(OH)3
D.Fe2O3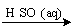 Fe2(SO4)3(aq)
Fe2(SO4)3(aq) 无水Fe2(SO4)3
无水Fe2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com