
| A、分子中N-Cl键是非极性键 |
| B、分子中不存在孤对电子 |
| C、它的沸点比PCl3沸点低 |
| D、因N-Cl键键能大,所以NCl3的沸点高 |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
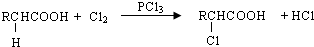 .
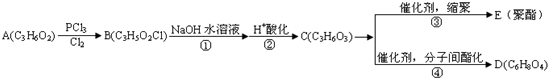
.
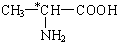
查看答案和解析>>
科目:高中化学 来源: 题型:
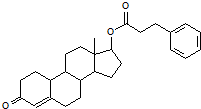
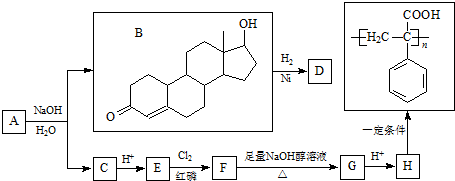
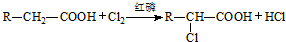
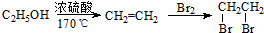
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在制取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸 |
| B、准确量取25.00mL高锰酸钾溶液,可选用50mL量筒 |
| C、测定中和热时,为了减少热量损失,不要搅拌溶液 |
| D、分离乙醇和乙酸乙酯的混合物用到的玻璃仪器是分液漏斗和烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合后,溶液中肯定有沉淀生成 |
| B、沉淀生成后溶液中Ag+的浓度为1×10-5 mol?L-1 |
| C、沉淀生成后溶液的pH=2 |
| D、混合后,升高温度,溶液中Ag+的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
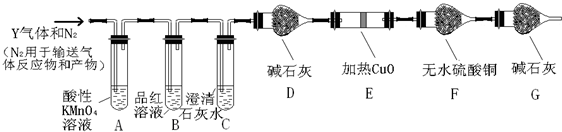
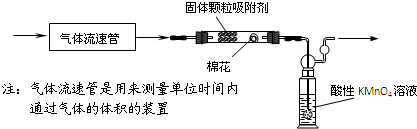
查看答案和解析>>
科目:高中化学 来源: 题型:
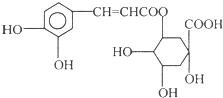 下列关于该化合物的说法不正确的是( )
下列关于该化合物的说法不正确的是( )| A、1mol绿原酸最多可与4mol NaOH发生反应 |
| B、与乙醇发生酯化反应后的有机物分子式为C18H24O9 |
| C、1mol绿原酸最多可与4 mol Br2发生反应 |
| D、能发生加成、取代、氧化、消去反应,也能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
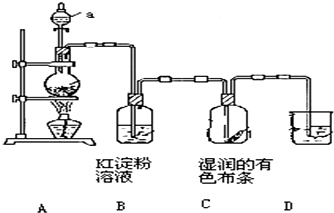
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com