
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
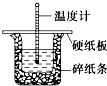 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A、该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变 |
| B、因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行 |
| C、根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol?L-1)3 |
| D、达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA |
| B、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
| C、常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
| D、V La mol?L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com