
分析 (1)每制得2g氢气需要吸收6.88×102kJ热量,即生成1mol氢气吸收6.88×102kJ热量,则生成3mol氢气吸收2.1×103 kJ热量,结合物质的状态书写热化学方程式;
(2)由CH4(g)+H2O(g)=CO(g)+3H2(g)、CO(g)+H2O(g)=CO2(g)+H2(g)可知,两式相加得到甲烷与水蒸气反应方程式;
(3)二氧化碳与足量NaOH反应生成碳酸钠和水;
(4)CO(g)+H2O(g)=CO2(g)+H2(g)为反应前后气体体积不变的反应.
解答 解:(1)每制得2g氢气需要吸收6.88×102kJ热量,即生成1mol氢气吸收6.88×102kJ热量,则生成3mol氢气吸收2.1×103 kJ热量,则热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2.1×103 kJ•mol-1或$\frac{1}{3}$CH4(g)+$\frac{1}{3}$H2O(g)=$\frac{1}{3}$CO(g)+H2(g)△H=+6.88×102 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2.1×103 kJ•mol-1或$\frac{1}{3}$CH4(g)+$\frac{1}{3}$H2O(g)=$\frac{1}{3}$CO(g)+H2(g)△H=+6.88×102 kJ•mol-1;
(2)由CH4(g)+H2O(g)=CO(g)+3H2(g)、CO(g)+H2O(g)=CO2(g)+H2(g)可知,两式相加得到甲烷与水蒸气反应方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g),
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g);
(3)二氧化碳与足量NaOH反应生成碳酸钠和水,而氢气不反应,涉及的离子反应为2OH-+CO2=CO32-+H2O,
故答案为:2OH-+CO2=CO32-+H2O;
(4)CO(g)+H2O(g)=CO2(g)+H2(g)为反应前后气体体积不变的反应,则固定容积时,反应过程中压强不变,故答案为:不变.
点评 本题考查反应热与焓变,为高频考点,把握热化学方程式的书写、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意平衡移动及盖斯定律应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,单位物质的量的气体所占的体积就叫气体的摩尔体积 | |
| B. | 物质的量是表示一定数目粒子集合体的一个物理量 | |
| C. | 0.012kg的碳中所含的碳原子数就是阿伏伽德罗常数 | |
| D. | Al原子的摩尔质量为27g,Al3+因少了3个电子,摩尔质量更小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
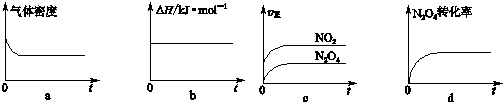
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
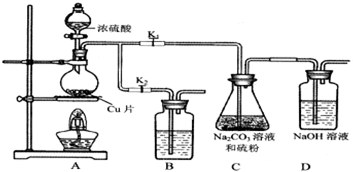
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
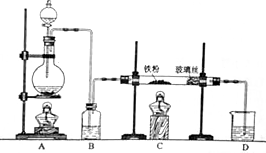 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
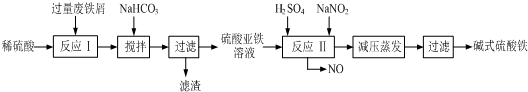
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com