
分析 (1)食盐和泥沙是互不相溶的两种物质,可以用过滤的方法来除;
(2)在粗盐提纯中,加入碳酸钠的作用是将杂质离子钙离子以及加入的多余的钡离子除去,根据离子反应应的条件来回答;
(3)A、粗盐中Na+数目N=nNA=$\frac{m}{M}$NA;
B、精盐中NaCl物质的量为n=$\frac{m}{M}$mol
C、粗盐中NaCl的质量分数为$\frac{氯化钠质量}{粗盐样品质量}$×100%;
D、精盐中NaCl物质的量为n=$\frac{m}{M}$mol.
(4)氧化还原反应中,化合价升高元素所在的产物是氧化产物,化合价降低元素所在的产物是还原产物,据此回答.
解答 解:(1)食盐水和泥沙是互不相溶的两种物质,为了除去粗盐中的泥沙,可以先溶解再过滤,故答案为:溶解、过滤;
(2)在粗盐提纯中,加入碳酸钠的作用是将杂质离子钙离子以及加入的多余的钡离子除去,实质是:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(3)A、粗盐中Na+数目N=nNA=$\frac{m}{M}$NA=$\frac{b}{58.5}$NA,故A错误;
B、精盐中NaCl物质的量为n=$\frac{m}{M}$mol=$\frac{b}{58.5}$mol,故B正确;
C、粗盐中NaCl的质量分数=$\frac{氯化钠质量}{粗盐样品质量}$×100%=$\frac{b}{a}$×100%,故C正确;
D、精盐中NaCl物质的量为n=$\frac{m}{M}$mol=$\frac{b}{58.5}$mol,故D错误.
故选BC;
(4)①在该反应中,碘酸钾中碘元素化合价降低,碘化钾碘元素化合价升高,所以3mol碘单质中0.5mol是氧化产物,2.5mol是还原产物,氧化产物和还原产物的质量比为1:5,故答案为:1:5.
点评 本题考查学生粗盐提纯以及氧化还原反应中的有关知识,是一道综合知识题目,可以根据所学知识进行回答,难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:填空题
 (1)如图为金刚烧的空间结构(碳架)
(1)如图为金刚烧的空间结构(碳架)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 工作时,电解质溶液中K+向负极移动 | |
| B. | 电路若有0.4mol电子通过,则消耗O2的量为0.2mol | |
| C. | 一段时间后溶液中OH-浓度将升高 | |
| D. | 正极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
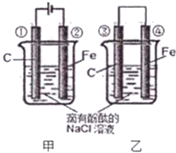 化学能和电能的相互转化是能量转化的重要形式,电池在现代生活的很多方面得到广泛应用.
化学能和电能的相互转化是能量转化的重要形式,电池在现代生活的很多方面得到广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 ( g )+$\frac{3}{2}$O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+$\frac{3}{2}$O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | NaI | C. | NaOH | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH 3COOCH2CH2CH3 | B. | CH3COOCH(CH3)2 | ||
| C. | CH3CH2COOCH2CH3 | D. | HCOOCH2CH(CH3)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com