
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
| 选项 | X | Y |
| A. | MgSO4 | CuSO4 |
| B. | AgNO3 | Pb(NO3)2 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.金属单质与盐溶液的反应都是置换反应
B.4Fe(OH)2+O2+2H2O===4Fe(OH)3属于化合反应
C.SO2+Cl2+2H2O===2HCl+H2SO4属于氧化还原反应
D.反应AgNO3+HCl===AgCl↓+HNO3不能说明盐酸酸性比硝酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为____________________。
(2)电池正极发生的电极反应为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
MgAgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+ Mg === Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是 ( )。
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验③、④说明该原电池中铜为正极、锌为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
3Zn(OH)2+2Fe(OH)3+4KOH。请回答下列问题:
①高铁电池的负极材料是________。
②放电时,正极发生________(填“氧化”或“还原”)
反应:已知负极反应为Zn-2e-+2OH-===Zn(OH)2,则正极反应为________________________________________________________________。
③放电时,________(填“正”或“负”)极附近溶液的碱性增强。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
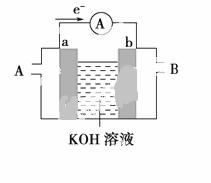
①使用时,空气从________口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为_______________________________________;
③假设使用的“燃料”是水煤气(成分为CO、H2),如用这种电池电镀铜,待镀金属的质量增加6.4 g,则至少消耗标准状况下水煤气的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1 mol CuCl(s),放出44.4KJ,该反应的热化学方程式是 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取。写出该反应的离子方程式,并标出电子转移的方向和数目 。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4 B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③ D.N2的转化率:②>①>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com