
| A. | 放电时:电子移动方向由Pb通过导线向PbO2传递 | |
| B. | 充电时:阳极反应是PbSO42-+2e-+2H2O═PbO2+SO42-+4H+ | |
| C. | 放电时:正极反应是Pb-2e-+SO42-═PbSO4 | |
| D. | 充电时:铅蓄电池的阴极应与电源的正极相连 |
分析 由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应;
A.放电时,电子方向由负极经导线流向正极;
B.充电时,阳极上失电子发生氧化反应;
C.放电时,正极上得电子发生还原反应;
D.充电时,铅蓄电池的负极要恢复原状,则应该作电解池阴极,与电源负极相连;
解答 解:A.放电时,Pb为电池负极,PbO2为正极,电子方向由负极Pb经导线流向正极PbO2,故A正确;
B.充电时,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故B错误;
C.放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,电极反应式为:PbO2+2e-+SO42-=PbSO4,故C错误;
D.充电时,铅蓄电池的负极要恢复原状,则应该作电解池阴极,与电源负极相连,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,明确正负极、阴阳极上得失电子及电极反应是解本题关键,难点是电极反应式的书写,注意原电池正负极上发生的反应为电解池阳极、阴极上发生反应的逆反应,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、SO42-、Cl-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ④③①② | C. | ③④①② | D. | ①③④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应,不必加热就能发生反应 | |
| B. | 化学反应一定有能量变化 | |
| C. | 化学反应中,吸热反应不一定需要加热也能发生 | |
| D. | 热化学反应方程式中,热效应数值与反应物的物质的量的多少有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡能导电的物质一定是单质 | |
| B. | 金属单质都能与稀硫酸发生置换反应 | |
| C. | 在化学反应中,金属单质失电子,常作还原剂 | |
| D. | 活泼金属都能从盐溶液中置换出较不活泼的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
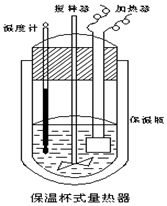 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com