
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
分析 根据△c=$\frac{△n}{V}$计算NO的浓度变化量,再根据v=$\frac{△c}{△t}$计算v(NO),反应速率之比等于化学方程式计量数之比计算v(H2O);
解答 解:30s后NO的物质的量增加了3mol,则△c(NO)=$\frac{3mol}{5L}$=0.6mol/L,
故v(NO)=$\frac{0.6mol/L}{30s}$=0.02mol/(L•s),V(NO)=$\frac{0.6mol/L}{0.5min}$=1.2mol/L•min,
则v(H2O)=$\frac{6}{4}$V(NO)=$\frac{6}{4}$×0.02mol/(L•s)=0.03mol•L-1•s-1,
v(H2O)=$\frac{6}{4}$V(NO)=$\frac{6}{4}$×1.2mol/L•min=1.8mol/(L•min)
故选CD.
点评 本题考查化学反应速率的计算,比较基础,注意对公式的理解与灵活运用,掌握基础是关键.


科目:高中化学 来源: 题型:选择题
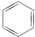 ③(CH3)2C=CH2④
③(CH3)2C=CH2④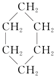 ⑤
⑤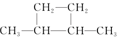
| A. | 链状烃:①③⑤ | B. | 链状烃:③⑤ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变为棕黄色,说明氯水中含有HClO | |
| C. | 向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与氧化镁共热可制取金属镁 | |
| B. | 铝分别与足量的 HCl溶液、足量的NaOH的溶液反应,产生的氢气前者多 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
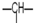 ,n3个-OH,其余为甲基.则甲基的个数为( )
,n3个-OH,其余为甲基.则甲基的个数为( )| A. | n1+n2+n3 | B. | 2n2+2n1-n3 | C. | n2+2-n3 | D. | 2n1+n2+2-n3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
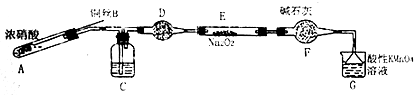
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.7 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com