
根据下列反应,可以判断有关物质的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2
④H2S+I2=S↓+2HI
A.H2S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>H2S>I2 D.Cl2>I2>Fe3+>H2S
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:填空题
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 。若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 ,混合气体的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:填空题
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶的白色固体,E则易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
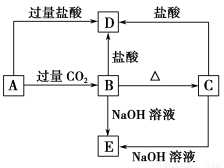
(1)写出化学式:A ,B ,C ,D ,E 。
(2)写出下列反应的离子方程式:
A→B: ;
A→D: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-1钠、镁及其化合物练习卷(解析版) 题型:选择题
从海水中提取镁的工艺流程可表示如下:
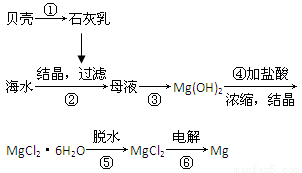
下列说法不正确的是( )。
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:(1)Tl3++2Ag=Tl++2Ag+,(2)Ag++Fe2+=Ag+Fe3+,(3)Fe+2Fe3+=3Fe2+,下列离子氧化性比较顺序正确的是 ( )。
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+
C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:填空题
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。
(2)下列三种情况下,离子方程式与 (1)相同的是 (填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的 (填序号)曲线表示。

(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。

查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:选择题
下列叙述中正确的是 ( )。
A.物质的溶解过程,实质上就是其电离过程
B.三氧化硫的水溶液能导电,所以三氧化硫是电解质
C.1 L 0.1 mol·L-1的H2SO4溶液中含有0.2 mol H+
D.1 L 0.1 mol·L-1的H2SO3溶液中含有0.2 mol H+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽中时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为ρ g·cm-3。该盐酸的物质的量浓度、溶质的质量分数分别为( )。
A.c=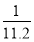 mol·L-1、w=
mol·L-1、w= %
%
B.c= mol·L-1、w=
mol·L-1、w=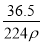 %
%
C.c= mol·L-1、w=
mol·L-1、w= %
%
D.c= mol·L-1、w=
mol·L-1、w=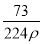 %
%
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:填空题
[物质结构与性质]已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题:
(1)写出F元素的电子排布式:________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为__________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子立体构型是________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
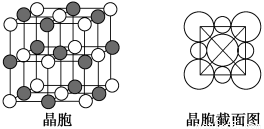
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com