
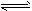 2SO2(g)+O2(g)��2NO(g)+O2(g)
2SO2(g)+O2(g)��2NO(g)+O2(g)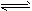 2NO2(g)��
2NO2(g)��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)������ϵͳ�ﵽƽ��ʱ��O2��NO2�����ʵ����ֱ�Ϊn(O2)=0.1 mol��n(NO2)=3.6 mol�����ʱSO3��������ʵ���Ϊ______________��
(2)������ϵͳ�ﵽƽ��ʱ���������������ƽ����ɣ������ٻ���Ҫ֪�����������ƽ��Ũ�ȣ������������岻��ͬʱ��SO3��______________����NO��______________(�����ǵķ���ʽ)��
(3)�������������������£�����Ϊ��ʼʱ��1 L�����г���2 mol NO2��2 mol SO2������������Ӧ�ﵽƽ��ʱ��cƽ(SO2)=______________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��4 mol SO3�����4 mol NO����2 L�����У���һ�������·������¿��淴Ӧ��������NO2��N2O4֮����ת������
2SO3��g��![]() 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2![]() 2NO2��
2NO2��
��1��������ϵͳ�ﵽƽ��ʱ��O2��NO2�����ʵ����ֱ�Ϊn(O2)=0.1 mol��n (NO2)=3.6 mol�����ʱSO3��������ʵ���Ϊ_____mol��
��2��������ϵͳ�ﵽƽ��ʱ���������������ƽ����ɣ���������Ҫ֪�����������ƽ��Ũ�ȣ������������岻��ͬʱ��SO3��_____����NO��_________ ���������ʽ��
��3����������һ��2 L��������ֻ������Ӧ2NO+O2![]() 2NO2������NO��O2��NO2����ʼŨ��������0.2 mol?L -1��0.1 mol?L -1��0.2 mol?L -1������Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ�����_____��ѡ����ĸ���ţ���
2NO2������NO��O2��NO2����ʼŨ��������0.2 mol?L -1��0.1 mol?L -1��0.2 mol?L -1������Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�ȿ�����_____��ѡ����ĸ���ţ���
A. c(NO)=0.35 mol?L -1��c(NO)=0.09 mol?L -1
B. c(NO2)=0.4 mol?L -1
C. c(NO2)=0.35 mol?L -1
D. c(O2)=0.2 mol?L -1��c(NO)=0.4 mol?L -1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��4�֣���4 mol SO3����4 mol NO����2 L�����У�һ�������·������¿��淴Ӧ(������NO2��N2O4֮����ת��)��?2SO3(g) 2SO2+O2?2NO+O2
2NO2?
(1)������ϵͳ�ﵽƽ��ʱ��O2��NO2�����ʵ����ֱ�Ϊn(O2)=0.1 mol��n(NO2)=3.6mol�����ʱSO3�������ʵ���Ϊ ��?
(2)������ϵͳ�ﵽƽ��ʱ���������������ƽ����ɣ������ٻ���Ҫ֪�����������ƽ��Ũ�ȣ������������岻��ͬʱ��SO3�� ����NO�� (�����ǵķ���ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012�����ʡ���һ�и߶���ѧ�ڶο���ѧ�Ծ� ���ͣ������
��4�֣���4 mol SO3����4 molNO����2L�����У�һ�������·������¿��淴Ӧ(������NO2��N2O4֮����ת��)��?2SO3(g)  2SO2+O2?2NO+O2
2SO2+O2?2NO+O2 2NO2?
2NO2?
(1)������ϵͳ�ﵽƽ��ʱ��O2��NO2�����ʵ����ֱ�Ϊn(O2)="0.1" mol��n(NO2)="3.6" mol�����ʱSO3�������ʵ���Ϊ ��?
(2)������ϵͳ�ﵽƽ��ʱ���������������ƽ����ɣ������ٻ���Ҫ֪�����������ƽ��Ũ�ȣ������������岻��ͬʱ��SO3�� ����NO�� (�����ǵķ���ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012�����ʡ�߶���ѧ�ڶο���ѧ�Ծ� ���ͣ������
��4�֣���4 mol SO3����4 mol NO����2 L�����У�һ�������·������¿��淴Ӧ(������NO2��N2O4֮����ת��)��?2SO3(g) 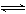 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2 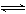 2NO2?
2NO2?
(1)������ϵͳ�ﵽƽ��ʱ��O2��NO2�����ʵ����ֱ�Ϊn(O2)=0.1 mol��n(NO2)=3.6 mol�����ʱSO3�������ʵ���Ϊ ��?
(2)������ϵͳ�ﵽƽ��ʱ���������������ƽ����ɣ������ٻ���Ҫ֪�����������ƽ��Ũ�ȣ������������岻��ͬʱ��SO3�� ����NO�� (�����ǵķ���ʽ)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com