
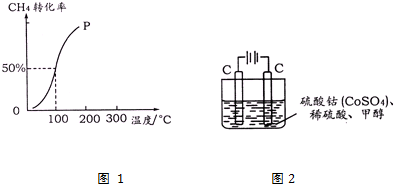
���� ��1��100��ʱ�ﵽƽ��ʱ������ת����Ϊ50%����ϻ�ѧƽ������ʽ��ʽ����ƽ��ʱ����ֵ����ʵ�����
�ٸ���c=$\frac{\frac{��n}{V}}{��t}$����v��H2����
�ڸ���ƽ��״̬���¶ȱ仯ʱ��ƽ���ƶ��ķ����жϡ�H1������ƽ��״̬ʱ�����ʵ�Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
��1�������������䣬ƽ����������ݻ�ѹ����ԭ����$\frac{1}{2}$��ѹǿ���������淴Ӧ���ʶ���������Ӧ����������࣬ƽ��������Ӧ�����ƶ����������Ũ�����������¶Ȳ��䣬��ƽ�ⳣ�����䣬���ƽ�ⳣ����֪��ƽ��ʱ��Ӧ�����ֵ�Ũ�ȶ����ݴ˷������
��3�������Ȼ�ѧ����ʽ���ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ��
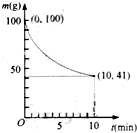
��4����ͨ���Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+��
����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+��ԭ���غ������غ��֪����ԭ����H+����ƽ��дΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��
��� �⣺��1����1.0mol CH4��2.0mol H2O �� g ��ͨ���ݻ��̶�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI����ͼ���֪100�����ת����Ϊ50%���ʲμӷ�Ӧ�ļ���Ϊ1mol��50%=0.5mol����
CH4 ��g��+H2O ��g��=CO ��g��+3H2 ��g��
��ʼ����mol����1.0 2.0 0 0
�仯����mol����0.5 0.5 0.5 1.5
ƽ������mol����0.5 1.5 0.5 1.5
�ټ���100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����=$\frac{\frac{1.5mol}{10L}}{5min}$=0.03 mol•L-1•min-1��
�ʴ�Ϊ��0.03 mol•L-1•min-1��
���ɼ����ת�������¶ȱ仯�����֪���ﵽƽ��������¶ȣ������ת��������֪ƽ�������ƶ�������H1����0��100��ʱ��ӦI��ƽ��Ũ��Ϊc��CH4��=0.05mol/L��c��H2O��=0.15mol/L��c��CO��=0.05mol/L��c��H2��=0.15mol/L��
ƽ�ⳣ��K=$\frac{0.05��0.1{5}^{3}}{0.05��0.15}$=2.25��10-2��
�ʴ�Ϊ�����ڣ�2.25��10-2��
��2��A��ƽ����������ݻ�ѹ����ԭ����$\frac{1}{2}$��ѹǿ����ƽ��������Ӧ�����ƶ����������Ũ����������ƽ�ⳣ�����䣬���ƽ�ⳣ����֪��ƽ��ʱ��Ӧ�����ֵ�Ũ�ȶ�����A����
B��ѹǿ���������淴Ӧ���ʶ���������Ӧ����������࣬��B����
C��ѹǿ����ƽ��������Ӧ�����ƶ���CH3OH �����ʵ������ӣ���C��ȷ��
D��ѹǿ����ƽ��������Ӧ�����ƶ������������ʵ�����С���״������ʵ�����������ƽ��$\frac{c��{H}_{2}��}{c��C{H}_{3}OH��}$��С����D��ȷ��
�ʴ�Ϊ��CD��
��3����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1272.8kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-552.6kJ•mol-1
��H2O��g���TH2O��l����H=-44.0kJ•mol-1
���ݸ�˹���ɣ�����֪��Ӧ$\frac{1}{2}$������-��+�ۡ�4���õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ�ġ�H=$\frac{1}{2}$��[��-1272.8kJ/mol��-��-552.6kJ/mol��+��-44.0kJ/mol����4]=-448.1 kJ•mol-1����CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-448.1 kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-448.1 kJ•mol-1��
��4����ͨ���Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+��
�ʴ�Ϊ��Co2+-e-=Co3+��
����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+�����ԭ���غ������غ��֪�����ӷ���ʽΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��˵����ԭ����H+���ʴ�Ϊ�����ɣ�
���� ���⿼���Ȼ�ѧ����ʽ��д����ѧƽ��ͼ��Ӱ�컯ѧƽ�����ء�ƽ�ⳣ���뷴Ӧ���ʼ��㡢ԭ��صȣ����ջ����ǽⱾ��Ĺؼ�����Ŀ�Ѷ��еȣ�


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2���SO2������O2��Ӧ��һ����������2���SO3 | |
| B�� | �����������䣬����ѹǿ������Ӧ���������淴Ӧ����Ҳ���� | |
| C�� | ����2molSO2��1molO2�ų��������Ǽ���1molSO2��0.5molO2�ų�������2�� | |
| D�� | �ڸ���������Ͷ��1molSO3��ƽ����ټ���1molSO3������ƽ���SO2�����������ԭƽ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ӧ���Ũ�ȣ�������λ����ڻ���ӵİٷ������Ӷ�ʹ��Ч��ײ�������� | |
| B�� | ������μӵĻ�ѧ��Ӧ��������ѹǿ������С��Ӧ������������������ӻ���ӵİٷ������Ӷ�ʹ��Ӧ�������� | |
| C�� | �����¶���ʹ��ѧ��Ӧ����������Ҫԭ���������˷�Ӧ������л���ӵİٷ��� | |
| D�� | ������Ȼ���μӻ�ѧ��Ӧ����������λ����ڻ���ӵ���Ŀ���Ӷ�����Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 CO2��һ���������壬�ݿ�ѧ��Ԥ�⣬��21������Ҷ��ȫ�����½�����1.5-4.5�棬�������µ���������ƽ�����ߣ�����������滷���������Ӱ�죮��κ���������CO2�ǰ��ڿ�ѧ����ǰ��һ���ش���⣮�ش��������⣺
CO2��һ���������壬�ݿ�ѧ��Ԥ�⣬��21������Ҷ��ȫ�����½�����1.5-4.5�棬�������µ���������ƽ�����ߣ�����������滷���������Ӱ�죮��κ���������CO2�ǰ��ڿ�ѧ����ǰ��һ���ش���⣮�ش��������⣺| CO2���� | NaOH��Һ���� | �ų������� | |
| �� | 22.0g | 750mL1.0mol•L-1 | xkJ |
| �� | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
| ���� | CO2��g�� | H2��g�� | CH4��g�� | H2O��g�� |
| Ũ��/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| �¶ȡ� | 700 | 800 | 880 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.0 | 10.0 | 15.0 | 16.1 | 17.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����������������ͻ�ѧ���ԣ����������������Ǹ�����ҵ����Ҫԭ�ϣ��ʻ����ᴿ�����漰��������Ӧ����Ϊ��
�����������������ͻ�ѧ���ԣ����������������Ǹ�����ҵ����Ҫԭ�ϣ��ʻ����ᴿ�����漰��������Ӧ����Ϊ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ѧ֪ʶ�ش��������⣺
�������ѧ֪ʶ�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com