
����Ŀ��ijУ��ѧ�о���ѧϰС����������˽�������ݣ�
�Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ������ˮ�����ڶ�Ԫ��ǿ�ᣨΪ������ʣ���������ǿ��̼�ᣬ���۵�Ϊ101.5�棬��157��������Ϊ̽������IJ��ֻ�ѧ���ʣ�����������ʵ�飺
��1����ʢ��1mL����NaHCO3��Һ���Թ��м��������Ҷ�����Һ���۲쵽����ɫ���ݲ������÷�Ӧ�����ӷ���ʽΪ________��
��2����ʢ���Ҷ��ᱥ����Һ���Թ��е��뼸�������ữ��KMnO4��Һ������������Һ���Ϻ�ɫ��ȥ����˵���Ҷ������______��������������������ԭ������������������������ƽ�÷�Ӧ�����ӷ���ʽ��_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2��+_____H2O
��3����һ�������Ҷ�������Թ��У�����ͼ��ʾװ�ý���ʵ�飨�г�װ��δ�������

ʵ�鷢�֣�װ��C��G�г���ʯ��ˮ����ǣ�B��CuSO4��ĩ������F��CuO��ĩ��졣�ݴ˻ش�
������װ���У�D��������_________��
���Ҷ���ֽ�Ļ�ѧ����ʽΪ ________��
��4����С��ͬѧ��2.52g���ᾧ�壨H2C2O42H2O�����뵽100mL 0.2mol/L��NaOH��Һ�г�ַ�Ӧ����÷�Ӧ����Һ�����ԣ���ԭ����_______�������ּ�����������Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ��_______�������ӷ��ű�ʾ����
���𰸡�HCO3-+H2C2O4=HC2O4-+CO2��+H2O ��ԭ�� 2 5 6 2 10 8 ��ȥ��������е�CO2 H2C2O4![]() H2O+CO��+CO2�� ��Ӧ������ҺΪNaHC2O4��Һ������HC2O4���ĵ���̶ȱ�ˮ��̶ȴ�����Һ��c��H+����c��OH������������Һ������ Na+��HC2O4-��H+��C2O42-��OH��
H2O+CO��+CO2�� ��Ӧ������ҺΪNaHC2O4��Һ������HC2O4���ĵ���̶ȱ�ˮ��̶ȴ�����Һ��c��H+����c��OH������������Һ������ Na+��HC2O4-��H+��C2O42-��OH��
��������
��1��ǿ��������ԭ����
��2�����Ը�����ؾ���ǿ�����ԣ�������л�ԭ�ԣ��ܱ����Ը���������������ݵ�ʧ�����غ�͵���غ���ƽ���ӷ���ʽ��
��3��H2C2O4![]() H2O+CO��+CO2����Bװ����֤����ˮ��Cװ����֤����CO2��Dװ�ó���CO2��Eװ�ó���ˮ������F��Gװ����֤����CO���ݴ˷�����
H2O+CO��+CO2����Bװ����֤����ˮ��Cװ����֤����CO2��Dװ�ó���CO2��Eװ�ó���ˮ������F��Gװ����֤����CO���ݴ˷�����
��4��ͨ�����㷴Ӧ����ҺΪNaHC2O4��Һ�����ݷ�Ӧ����Һ�����ԣ���֪HC2O4- �ĵ���̶ȱ�ˮ��̶ȴ��ɴ�ȷ����Һ�и�����Ũ�ȵ���С��
��1���Ҷ����к����Ȼ����������ԣ����Ա�̼��ǿ����̼�����Ʒ�Ӧ���ɶ�����̼�������ƣ��÷�Ӧ�����ӷ���ʽΪ��HCO3-+H2C2O4=HC2O4-+CO2��+H2O��
�𰸣�HCO3-+H2C2O4=HC2O4-+CO2��+H2O��
��2������KMnO 4 ��Һ����ǿ�����ԣ���ʢ�������Ҷ��ᱥ����Һ���Թ��е����������ữ��KMnO 4��Һ������������Һ���Ϻ�ɫ��ȥ��˵���Ҷ��ᱻ���Ը���������������л�ԭ�ԣ�����������ԭ��Ӧ����ʽ����ƽԭ��ʧ�����غ㡢�����غ�͵���غ���ƽ�÷�Ӧ�����ӷ���ʽ��2MnO 4 - +5 H2C2O4 +6H + =2Mn 2+ +10CO 2 ��+8H2O��
�𰸣���ԭ�� 2 5 6 2 10 8
��3�������Ҷ��ᣬ��Ӧ��ͨ��B��ʹCuSO 4 ��ĩ������˵����ˮ���ɣ�װ��C�г���ʯ��ˮ����ǣ�˵���ж�����̼���ɣ�װ��D�ж�����̼���������Ʒ�Ӧ��ȥ��������еĶ�����̼��F��CuO��ĩ��졢G�г���ʯ��ˮ�����˵����һ����̼���ɣ������Ҷ���ķֽ����ΪCO��CO 2 ��H2O��
�𰸣���ȥ��������е�CO2�� H2C2O4![]() H2O+CO��+CO2����
H2O+CO��+CO2����
��4����2.52g���ᾧ������ʵ���= ![]() =0.02mol��100mL 0.2mol/L��NaOH��Һ���������Ƶ����ʵ���=100mL��10 -3 L/mL��0.2mol/L=0.02mol�����Է�Ӧ����NaHC2O4 ��������ҺΪNaHC2O4��Һ������HC2O4 - �ĵ���̶ȱ�ˮ��̶ȴ�����Һ��c��H + ����c��OH - ����������Һ�����ԣ�
=0.02mol��100mL 0.2mol/L��NaOH��Һ���������Ƶ����ʵ���=100mL��10 -3 L/mL��0.2mol/L=0.02mol�����Է�Ӧ����NaHC2O4 ��������ҺΪNaHC2O4��Һ������HC2O4 - �ĵ���̶ȱ�ˮ��̶ȴ�����Һ��c��H + ����c��OH - ����������Һ�����ԣ�
����������1��1��Ӧ����NaHC2O4����Һ�����ԣ�˵��HC2O4 - �ĵ���̶ȱ�ˮ��̶ȴ���Һ�л�������ˮ�ĵ��룬��H+��C2O42-���������ӵĵ���̶Ƚ�С������HC2O4-��H+������Ũ���ɴ�С��˳��ΪNa+��HC2O4-��H+��C2O42-��OH����
�𰸣���Ӧ������ҺΪNaHC2O4��Һ������HC2O4���ĵ���̶ȱ�ˮ��̶ȴ�����Һ��c��H+����c��OH������������Һ������ Na+��HC2O4-��H+��C2O42-��OH��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����50.00mLδ֪Ũ�ȵİ�ˮ����μ���0.5mol��L-1��HC1��Һ���ζ������У���Һ��pOH[pOH=��lgc(OH-)]�����HCl��Һ����Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����

A. ͼ�Тڵ���ʾ��Һ�ĵ����������ڢٵ�
B. �۵㴦ˮ�������c(H+)=1��10-8mol��L-1
C. ͼ�е����ʾ��Һ�У�c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25��ʱ��ˮ��KbԼΪ5��10-5.6mo1��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е�˵������ȷ���ǣ���
A.0.1mol Fe��0.lmol Cl2�г��ȼ�գ�ת�Ƶ�����Ϊ0.2NA
B.12mol/L��Ũ����50ml��������Cu���ȷ�Ӧ���õ�SO2Ϊ0.3NA
C.1 mol Cl2������NaOH��Һ��Ӧ�õ�������Ϊ2NA
D.1 mol Na2O2������ˮ��Ӧת�Ƶ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������пұ��������ZnSO4��CuSO4��FeSO4��FeS2��Al2O3��SiO2���Ʊ�ZnSO4��Fe2O3��ʵ������������

��֪���������ʱ��NaOH��ҺŨ��Խ��Խճ����Խ���������������Ƴ�����
��1�� ��ˮ����������70��80�������½��У����˵ļ��ȷ�ʽΪ________________��
��2�������������ǽ�Fe2+�������һ������Fe(OH)3���ӷ�Ӧ����ĽǶȷ���������ˮ���H2O2��ȱ���Ǣ�ʹZnSO4�л���ZnCl2����________________��
��3�������ա�ʱFeS2������Ӧ�Ļ�ѧ����ʽΪ________________��ʹ�õ�װ������ͼ������a������Ϊ________________��
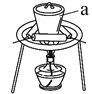
��4�� ��������Σ��������������������£����ù�����Fe2O3������NaOH��Һ��Ũ�ȵ��������������������Ũ�ȴ���12 mol��L��1ʱ��Fe2O3�����������ͣ���ԭ����________________��
��5������Һ��������Ҫ��ZnSO4��CuSO4����֪����п������ܽ�����¶ȱ仯����ͼ������ƴӡ���Һ���л�ȡZnSO4�����ʵ�鷽����________________��ʵ������ʹ�õ��Լ��У�Zn�ۡ�ϡH2SO4���ƾ�����
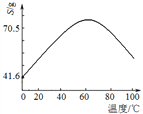
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʾ4��װ��ͼ������˵������ȷ����
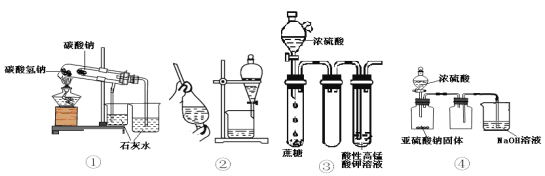
A. ��װ�ÿ����ڱȽ�NaHCO3��Na2CO3���ȶ��� B. �þƾ���ȡ��ˮ�е����ѡ���װ��
C. ���װ�ý���ʵ��ɿ�������KMnO4��Һ��ɫ D. ��װ�ÿ�����ʵ������ȡ���ռ�����SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Ŵ��Ĵ���֮һ�����ڻ�ҩ�����ڱ�ըʱ�����Ļ�ѧ��ӦΪ2KNO3+3C+S=A+N2��+3CO2��(����ƽ)
��1���ٳ�S�⣬����Ԫ�صĵ縺�ԴӴ�С����Ϊ__________��
�����������У�A�ľ�������Ϊ_______�������Թ��ۼ��ķ��ӵ�����ԭ�ӹ���ӻ�����Ϊ_____��
����֪CN-��N2��Ϊ�ȵ����壬����HCN������������������Ŀ֮��Ϊ_____��
��2��ԭ������С��36��Ԫ��Q��T�������ڱ��мȴ���ͬһ������λ��ͬһ�壬��ԭ������T��Q��2��T�Ļ�̬ԭ����Χ����(�۵���)�Ų�Ϊ______��Q2+��δ�ɶԵ�������_______��
��3����ij�������ʾ�����ԭ�ӵĶѻ���ʽ��ͼ����ʾ���侧��������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ��ͼ����ʾ�����и�ԭ�ӵ���λ��Ϊ________���õ��ʾ�����ԭ�ӵĶѻ���ʽΪ���ֻ����ѻ���ʽ�е�________��
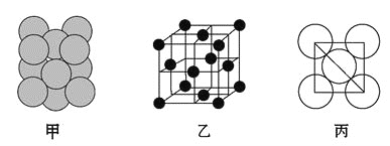
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵���������
A. PM2.5��ָ����������2.5��m�Ŀ���������������
B. ��ɫ��ѧҪ���Դͷ�����������������Ի�������Ⱦ
C. ȼú�м���CaO���Լ���������γɼ�����������ŷ�
D. ��Ȼ����Һ��ʯ�������ҹ�Ŀǰ�ƹ�ʹ�õ����ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У�������ȷ���ﷴӦ��ɫ�仯����
A. ��CuSO4��Һ�м�������Zn�ۣ���Һ��ɫ��ʧZn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. �����ʯ��ˮ���ú���ְ�ɫ����Ca(OH)2+CO2![]() CaCO3��+H2O
CaCO3��+H2O
C. Na2O2�ڿ����з��ú��ɵ���ɫ��Ϊ��ɫ2Na2O2![]() 2Na2O+O2��
2Na2O+O2��
D. ��Mg(OH)2����Һ�еμ�����FeCl3��Һ���ֺ��ɫ����3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ�����壬���ܱ������з������·�Ӧ��xA��g����yB��g��![]() zC��g�����ﵽƽ�����A�����Ũ��Ϊ0.5 mol��L-1���������½��ܱ��������ݻ����������ٴﵽƽ����AŨ��Ϊ0.3 mol��L-1��������������ȷ����
zC��g�����ﵽƽ�����A�����Ũ��Ϊ0.5 mol��L-1���������½��ܱ��������ݻ����������ٴﵽƽ����AŨ��Ϊ0.3 mol��L-1��������������ȷ����
A. ƽ��������Ӧ�����ƶ� B. x+y��z
C. C ������������� D. B��ת�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com