
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
Ⅰ、草酸亚铁晶体的制备:

(1)步骤①硫酸亚铁铵晶体加稀硫酸溶解的原因是___________________。
(2)步骤2倾析的作用是使固液分离,具体操作是静置后,将沉淀上部的溶液倾入另一容器,从而获得固体。倾析法与普通的过滤相比,明显的优点是____________________。
(3)硫酸亚铁铵俗称莫尔盐,在空气中比一般的亚铁盐稳定,较难被氧化,其水溶液的性质与组成它的简单盐的混合溶液没有区别。设计简单实验证明硫酸亚铁铵比硫酸亚铁更稳定______________________。
Ⅱ、测定草酸亚铁的纯度:
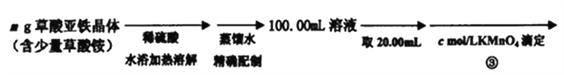
(4)在步骤③的溶液中除发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O 外,还有另一氧化还原反应,写出该反应的离子方程式__________________ ;用KmnO4标准溶液滴定至终点的现象是_____________________。
(5)步骤④加入适量锌粉的目的是________________。
(6)相同条件下,重复滴定三次,步骤③平均消耗KmnO4标准溶液V1mL,步骤⑤平均消耗V2mL,则mg固体样品的纯度计算式为______________。(用相关字母表示,不必化简)
【答案】 抑制Fe2+的水解 操作简便、加快固液分离的速率(回答一个即得分) 取等物质的量的硫酸亚铁铵和硫酸亚铁固体,空气中放置相同的数分钟,用等体积和不含氧的蒸馏水溶解(各加入同浓度、等体积的硫酸),再加入2滴同浓度的KSCN溶液,观察到硫酸亚铁溶液的颜色更深,说明硫酸亚铁铵比硫酸亚铁更稳定 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 最后一滴标准溶液加入后,锥形瓶中的溶液颜色由黄色变为淡红色,且半分钟内不褪色 将Fe3+还原为Fe2+ 4.5cV2/m×l00%
【解析】Ⅰ、(1)Fe2+易发生水解Fe2++2H2O Fe(OH)2+2H+,在溶解的过成中,加入与其阴离子对应的酸(硫酸)抑制Fe2+的水解,故答案为:抑制Fe2+的水解;
(2)过滤,水浸过滤纸的速度较慢;倾析法直接倾倒,相较而言,操作更为简便、分离速率也快。故答案为:操作简便、加快固液分离的速率;
(3)根据已知:硫酸亚铁铵在空气中比一般的亚铁盐稳定,可以确定实验思路,将要比较的两种盐都放置在空气中一段时间,然后比较氧化产物Fe3+的存在情况。实验过程中,要注意控制变量,即除了硫酸亚铁铵和硫酸亚铁这两种药品本身不同之外,其他的反应条件时间均要相同。实验设计表述为:取等物质的量的硫酸亚铁铵和硫酸亚铁固体,空气中放置相同的数分钟,用等体积和不含氧的蒸馏水溶解(各加入同浓度、等体积的硫酸),再加入2滴同浓度的KSCN溶液,观察到硫酸亚铁溶液的颜色更深,说明硫酸亚铁铵比硫酸亚铁更稳定。
Ⅱ、流程的目的为测定草酸亚铁的纯度,可以通过测定Fe2+的量而间接得出草酸亚铁的量。取mg的样品晶体溶解后配制成100mL。取2OmL样液,用高锰酸钾标准溶液滴定,消耗V1mL高锰酸钾溶液。滴定后,溶液中的Fe2+转化为Fe3+,H2C2O4转化为CO2。因为样品中含有草酸铵,所以不能根据这一次滴定数据计算草酸亚铁。滴定后的溶液中存在Fe3+,加入Zn粉将Fe3+还原为Fe2+,再次用高锰酸钾溶液滴定消耗V2mL高锰酸钾溶液。
(4)草酸亚铁晶体溶于稀硫酸后,C2O42-与H+结合为H2C2O4,溶液中含有两种还原性物质:Fe2+和H2C2O4,加入KMnO4溶液后,KMnO4也能将H2C2O4氧化为CO2,发生反应为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;当高锰酸钾将Fe2+和H2C2O4反应完全后,再加入高锰酸钾,溶液会立即变红色,振荡,半分钟内颜色不会褪去,即达到滴定终点,停止滴定。
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;最后一滴标准溶液加入后,锥形瓶中的溶液颜色由黄色变为淡红色,且半分钟内不褪色;
(5)根据上述分析,步骤④中加入Zn粉的目的:将Fe3+还原为Fe2+;
(6)步骤⑤中滴定Fe2+消耗V2mL高锰酸钾溶液,根据方程式可列式子计算。
5Fe2+ + MnO4-+8H+═5Fe3++Mn2++4H2O
5mol1mol
ncV2×10-3mol
所以,n=5cV2×10-3(原样液取的是20mL)
所以,mg样品含有Fe2+物质的量为5cV2×10-3mol×![]() =2.5cV2×10-2mol
=2.5cV2×10-2mol
所以,FeC2O4·2H2O的质量分数=![]() =4.5cV2/m×l00%
=4.5cV2/m×l00%


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜、石墨均导电,所以它们均是电解质
B. NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C. 液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质
D. 蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存的是
A. Na+、Mg2+、Cl-、OH- B. H+、Ca2+、CO32-、NO3-
C. Cu2+、K+、SO42-、NO3- D. Na+、H+、OH-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).
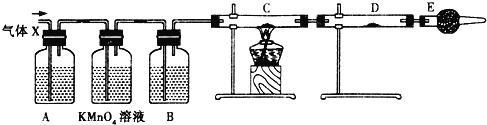
注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 沸点:H2O>HFB. 热稳定性:HF>H2O
C. NCl3、SiCl4分子中每个原子最外层均满足8电子结构D. 仅由N、H、O三种元素形成的化合物中不可能含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
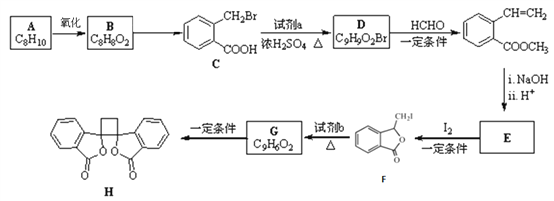
【题目】[化学一选修5:有机化学基础]具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
已知:
ⅰ. ![]()
ⅱ. ![]()
ⅲ. 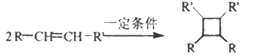
(以上R、R’、R”代表氢、或烃基等)
(1)A属于芳香烃,名称是______________,由B生成C的反应类型是________________。
(2)试剂a是_________________,HCHO的电子式是________________。
(3)E的结构简式是_________________。
(4)由F生成G的化学方程式是____________________。
(5)二取代芳香化合物W是 同分异构体,能使溴的四氯化碳溶液反应,能发生银镜反应,W共有____种(不含立体结构)。其中核磁共振氢谱为五组峰的结构简式为________。
同分异构体,能使溴的四氯化碳溶液反应,能发生银镜反应,W共有____种(不含立体结构)。其中核磁共振氢谱为五组峰的结构简式为________。
(6)以乙醇为起始原料,结合已知信息选用必要的无机试剂合成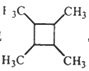 ,写出合成路线(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________________。
,写出合成路线(用简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表:下列叙述正确的是( )
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C.830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆
D.830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com