
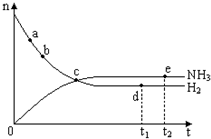
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa��n��NH3����n��H2����ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ�������| A�� | ��a������Ӧ���ʱȵ�b�Ĵ� | |
| B�� | �� c����Ӧ�ﵽƽ�� | |
| C�� | ��d��t1ʱ�̣� �͵�e��t2ʱ�̣���n��N2����һ�� | |
| D�� | �����������䣬573K�·�Ӧ��t1ʱ�̣�n��H2����ͼ��d���ֵ�� |
���� A��a��b����������Ӧ���У�Ũ��Խ��Ӧ����Խ�죻
B��c��������ʵ��������䣬�������ʵ�����С�����䣬��c�㷴Ӧ������Ӧ���У�
C��d���e�㶼����ƽ��״̬��n��N2�����䣻
D���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ������ƽ�������ƶ���
��� �⣺A��a��b����������Ӧ���У����ŷ�Ӧ�Ľ��У���Ӧ���Ũ����С����Ӧ������С����a�������Ӧ���ʱ�b���A��ȷ��
B��c��������ʵ��������䣬�������ʵ�����С�����䣬c��δ����ƽ��״̬����Ӧ������Ӧ���У���B����
C��d���e�㶼����ƽ��״̬��n��N2�����䣬d���e��n��N2����ȣ���C����
D���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ����������ƽ�������ƶ������������ʵ�����С����D����
��ѡ��A��
���� ���⿼�黯ѧƽ��ͼ��ƽ��״̬�������ѶȲ���ע�����⻯ѧƽ��״̬��������


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1�����칬һ�š���2011��9���ھ�Ȫ���Ƿ������ķ��䣬��־���ҹ��ĺ��պ��켼��������һ������ĵ�һ�������������У����õ�ȼ��Ϊƫ�����ݺ�������������ƫ�����¿��������Ʊ���
��1�����칬һ�š���2011��9���ھ�Ȫ���Ƿ������ķ��䣬��־���ҹ��ĺ��պ��켼��������һ������ĵ�һ�������������У����õ�ȼ��Ϊƫ�����ݺ�������������ƫ�����¿��������Ʊ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
��CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3OH��ȼ����Ϊ192.9kJ/mol | |
| B�� | ��Ӧ���е������仯��ͼ��ʾ�� | |
| C�� | ���ݢ���֪��ӦCH3OH��l��+$\frac{1}{2}$O2��g���TCO2��g��+2H2��g���ġ�H��-192.9kJ/mol | |
| D�� | CH3OHת���H2�Ĺ���һ��Ҫ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ͼ��գ�
����ͼ��գ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com