
| A. | 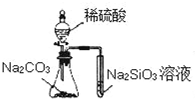 实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 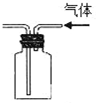 实验装置排空气法收集CO2气体 | |
| C. | 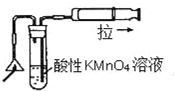 可以检验火柴燃烧生成的SO2气体 | |
| D. |  提取海带中的碘 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.气体密度大于空气,且和空气不反应的气体应该采用向上排空气法收集;
C.二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色;
D.海带中碘以碘离子存在,不能采用萃取方法得到碘.
解答 解:A.强酸制取弱酸可知酸性为硫酸>碳酸>硅酸,最高价含氧酸的酸性越强,非金属性越强,则可比较硫、碳、硅三种元素的非金属性强弱,故A正确;
B.二氧化碳的密度比空气的大,应利用向上排空气法收集,图中应长导管中进,故B错误;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色,图中试管中的导管长短应互换,故C错误;
D.海带中碘以离子的形式存在,应先发生氧化还原反应后生成碘单质,再萃取、分液,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及酸性强弱比较、气体收集、氧化还原反应、萃取等知识点,明确实验原理、物质性质、物质分离提纯方法是解本题关键,侧重考查学生分析判断能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
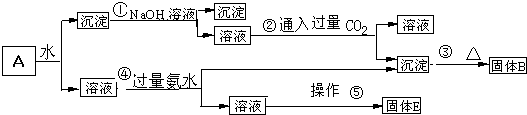
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 数据 编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | 1 |
| ② | a | 7 | x |
| ③ | 20.00 | >7 | y |
| A. | 由表中数据可估算出HX的电离常数Ka(HX)≈10-5 | |
| B. | 向上述实验③HX反应后的溶液中加入实验①中的HY溶液前后,水的电离程度增大 | |
| C. | 表中x<7,y=7 | |
| D. | 上述向HX中加amLNaOH时,溶液中c(Na+)=c(X-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的三倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
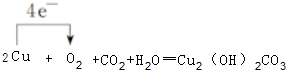 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
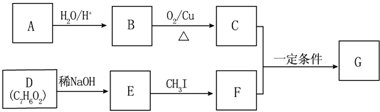
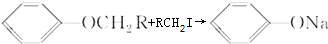
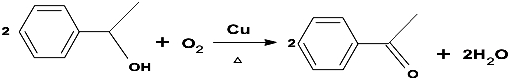 .
.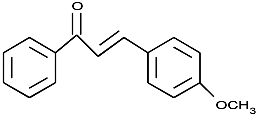 (不要求立体异构).
(不要求立体异构).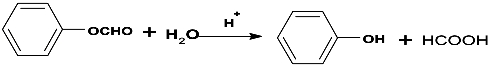 .
.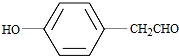 .(写结构简式)
.(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B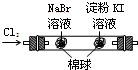 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D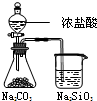 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com