
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
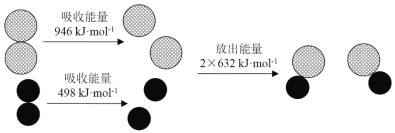
A. 1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸热反应一定需要加热才能发生
【答案】B
【解析】
A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO,△H=946kJ/mol+498kJ/mol-2×632kJ/mol=180kJ/mol,故该反应是吸热反应,故A错误;B.依据A计算可知反应是吸热反应,故1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;C.通常情况下,N2(g)和O2(g)混合不能直接生成NO,在放电或高温条件才能反应,故C错误;D.吸热反应不一定需要加热,如氢氧化钡晶体与氯化铵固体的反应,在常温下就能进行,但该反应为吸热反应,故D错误;故选B。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为 __________ g,假设广口瓶里生成一种正盐,其质量为 __________ g;
(2)生成的水中氢元素的质量为 __________ g;
(3)生成的二氧化碳中碳元素的质量为 __________ g;
(4)该燃料中碳元素与氢元素的物质的量之比为 __________ ;
(5)已知这种醇的每个分子中含有一个氧原子,则该醇的分子式为 __________ ,结构简式为 __________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,属于同位素的是(填序号,下同)________,属于同素异形体的是________ ,互为同系物的是__________ ,属于同分异构体的是____________ ,属于同种物质的是____________。
A.O2和O3 B.![]()
![]()
![]()


(2)下面的键线式表示维生素A的分子结构:

① 该分子内含有__________个碳原子,_________个氢原子,_________个氧原子;维生素A中氧的质量分数是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物可以通过光合作用在体内合成有机物,被称为生物质(以淀粉为代表),具有广阔的应用前景。已知生物质的主要转化途径及主要产物如图所示:
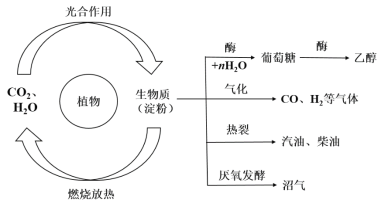
请回答:
(1)农村燃烧沼气供能的反应类型为下列的______。
A.吸热反应 B.放热反应 C.氧化还原反应 D.非氧化还原反应
(2)写出葡萄糖的化学式________________,上图由葡萄糖得到乙醇的反应中另一种气体产物的结构式为__________________。
(3)下列说法不正确的是______。
A.生物质中的能量本质上来自于太阳能
B.生物质气化产物中所含的能量既属于化学能,又属于生物质能
C.上图中生物质的所有转化均为化学反应
D.直接燃烧生物质是一种高效利用能源的方式
(4)已知18 g的葡萄糖固体被氧气完全氧化生成两种气体产物时放出热量254 kJ,写出该反应的热化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用化学反应原理知识解决下列问题
(1)写出醋酸(CH3COOH) 的电离方程式: _____________。
(2)明矾净水的原理为(用离子方程式表示)____________________________。
(3)一定条件下,56g金属铁与足量CO2气体完全反应生成碳单质和氧化铁固体时,放出117kJ热量,该反应的热化学方程式为_______________________。
(4) 现有浓度为0.1mol/L 的三种电解质溶液①NaHCO3 ②Na2CO3 ③NaOH 这三种溶液的pH 由小到大的顺序是__________________ (填编号)。
(5)常温下,下列事实能证明HA是弱电解质的是________ (填编号)。
a.某NaA溶液的pH=9
b.用HA 溶液做导电实验,灯泡很暗
c.等物质的量浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多d.0.1mol/LHA 溶液的pH≈2.8
(6)已知在100℃时,水的离子积为1×10-12,此时将 pH= 11 的 NaOH 溶液V1 L 与pH=2的H2SO4溶液V2 L均匀混合后,若所得混合溶液的pH=10,则V1: V2为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com