
【题目】反应3X(g)+Y(g) 2Z(g)+2W(g)在2 L密闭容器中进行,5 min时Y减少了0.5 mol,0~5 min内此反应的平均速率为
A.v(X)=0.05 mol·L1·min1
B.v(Y)=0.10 mol·L1·min1
C.v(Z)=0.10 mol·L1·min1
D.v(W)=0.05 mol·L1·s1
【答案】C
【解析】
根据v=![]() 计算v(Y),再利用速率之比等于化学计量数之比求出用其它物质表示的反应速率,据此判断。
计算v(Y),再利用速率之比等于化学计量数之比求出用其它物质表示的反应速率,据此判断。
v(Y)= =0.05molL-1min-1,
=0.05molL-1min-1,
A.速率之比等于化学计量数之比,所以v(X)=3v(Y)=3×0.05molL-1min-1=0.15 molL-1min-1,故A错误;
B.v(Y)= =0.05molL-1min-1,故B错误;
=0.05molL-1min-1,故B错误;
C.速率之比等于化学计量数之比,所以v(Z)=2v(Y)=2×0.05molL-1min-1=0.1 molL-1min-1,故C正确;
D.速率之比等于化学计量数之比,所以v(W)=2v(Y)=2×0.05 molL-1min-1=0.1 molL-1min-1=0.0017molL-1s-1,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】(1)CH4与Cl2发生反应的条件是________;实验中可观察到量筒内液面________,量筒内壁出现油状液滴,其中________是工业上重要的溶剂;饱和食盐水中有少量固体析出,用饱和食盐水而不用水的原因是______________________________。

(2)在浓硫酸作用下,苯在水浴加热时可以与浓硝酸反应生成硝基苯,该反应的化学方程式为_____________
(3)写出实验室制取乙酸乙酯的化学方程式:__________________________________;实验中饱和碳酸钠溶液的作用是(填字母)________________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
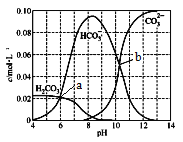
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的 SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(1)为加快工业废碱渣中 Na2CO3 的溶解,可采取的措施是_____(写出一种即可)。
(2)上述流程中,加入NaOH 后,发生反应的化学方程式为_____。
(3)亚硫酸钠粗品中含有少量Na2SO4,原因是_____。
(4)设计实验证明亚硫酸钠粗品含有少量 Na2SO4 的方案是:在一支试管中,加入少量 亚硫酸钠粗品,用适量蒸馏水溶解,_____,出现白色沉淀,则证明含有 Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =________________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH_____0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=________________________(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(H00C-COOH)。其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl。下列说法正确的是( )

A. 盐酸是起提供Cl-和增强导电性的作用
B. Pt1的电极反应为:4OH--4e-=2H2O+O2↑
C. 每消耗0.1mol乙二醛在Pt1极放出2.24L气体(标准状况)
D. 每得到lmol乙二酸将有2molH+从右室迁移到左室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________;
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________;
(3)元素⑦的氢化物分子式为__________,该氢化物常温下和元素①的单质反应的离子方程式是__________,该氢化物与元素⑧的单质反应的离子方程式是__________;
(4)①和⑧的最高价氧化物对应的水化物化学式为__________和__________。①和⑨两元素形成化合物的化学式为__________,该化合物灼烧时焰色为__________,该化合物的溶液与元素⑧的单质反应的离子方程式为__________;
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,下列说法正确的是
分别表示N2、H2、NH3,下列说法正确的是


A. 使用催化剂,合成氨反应放出的热量减少
B. 在该过程中,N2、H2断键形成N原子和H原子
C. 在该过程中,N原子和H原子形成了含有非极性键的NH3
D. 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量
B.向 AlCl3 溶液中逐滴 滴加氨水至过量
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量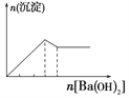
D.向澄清石灰水中缓缓 通入 CO2 至过量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com