

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
| (3mol/L)2 |
| (2mol/L)2?(1mol/L)3 |
| 3 |
| 4 |


科目:高中化学 来源:不详 题型:单选题
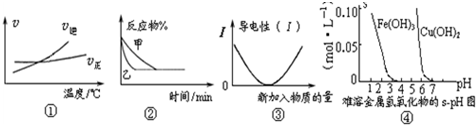
| A.根据图①可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是吸热反应 |
| B.图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节至pH在4左右 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
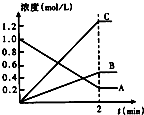
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.达平衡时,CH4(g)的转化率为75% |
| B.O-10min内,v(CO)=0.075mol?L-1.min-1 |
| C.该反应的化学平衡常数K=O.1875mol?L-1 |
| D.当CH4(g)的消耗速率与H20(g)的生成速率相等,反应到达平衡 |
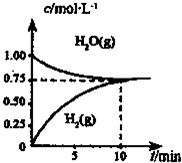
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2mol SO2+1mol O2 |
| B.4mol SO2+1mol O2 |
| C.2mol SO2+1mol O2+2mol SO3 |
| D.3mol SO2+1mol SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.17% | B.5% | C.25% | D.33% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.增大B的浓度 | B.升高温度 |
| C.加入催化剂 | D.增大压强 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com