
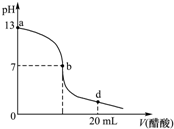
 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )| A. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-) | |
| D. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L |
分析 未加醋酸时,NaOH溶液的pH=13,NaOH是强碱,则该溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L;
醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以醋酸和NaOH恰好完全反应的溶液呈碱性;
d点时,n(醋酸)=0.2mol/L×0.02L=0.004mol>n(NaOH)=0.1mol/L×0.02L=0.002mol,该点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,且醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性;
任何溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:未加醋酸时,NaOH溶液的pH=13,NaOH是强碱,则该溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L;
醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以醋酸和NaOH恰好完全反应的溶液呈碱性;
d点时,n(醋酸)=0.2mol/L×0.02L=0.004mol>n(NaOH)=0.1mol/L×0.02L=0.002mol,该点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,且醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性;
A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,所以醋酸和NaOH恰好完全反应的溶液呈碱性,所以氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线a、b间的某点,故A错误;
B.b点溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以得c(Na+)=c(CH3COO-),故B正确;
C.点时,n(醋酸)=0.2mol/L×0.02L=0.004mol>n(NaOH)=0.1mol/L×0.02L=0.002mol,该点溶液中溶质为等物质的量浓度的醋酸钠和醋酸,且醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-),故C正确;
D.根据以上分析知,c(NaOH)=0.1mol/L,故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确曲线上溶液中的溶质及其性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ①③⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用锌粒代替锌粉 | B. | 向其中加入少量1mol/L硫酸溶液 | ||
| C. | 向其中加入氯化钠溶液 | D. | 向其中加入等体积的水 | ||
| E. | 向其中加入碳酸钠溶液 | F. | 向其中加入硝酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y的总能量一定高于M和N的总能量 | |
| B. | X能量一定高于Y | |
| C. | 因该反应为放热反应,故不必加热就可发生 | |
| D. | Y能量一定高于N |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中无沉淀,加入Na2CO3溶液中有白色沉淀 | |
| D. | 等浓度的两种盐溶液分别与等浓度的盐酸反应,碳酸氢钠溶液的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 乙酸丙酯 | D. | 丙酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
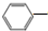 CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$
CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$ CHCl-CH3(g)+HCl(g)△H>0
CHCl-CH3(g)+HCl(g)△H>0| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
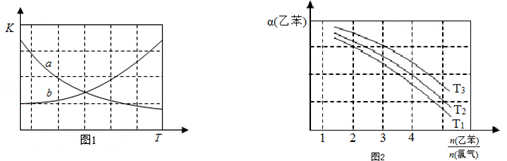
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)△H=+124kJ/mol
CH=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com