
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
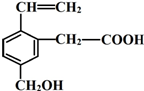 某有机物的结构简式如图,该物质可能有的化学性质是( )
某有机物的结构简式如图,该物质可能有的化学性质是( )| A. | ①②③⑥ | B. | ①②④⑤ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前应先检查它是否漏水 | |
| B. | 容量瓶先用蒸馏水洗净,再用待配液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2 cm处,再改用胶头滴管滴加蒸馏水至刻度线 | |
| D. | 浓硫酸稀释后马上转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是把可称量物质与微观粒子联系起来的一个国际基本物理量 | |
| B. | 气体的摩尔体积与温度和压强有关,温度越高,体积越大 | |
| C. | 任何一种微观粒子,其摩尔质量以g/mol为单位,数值与这种粒子的相对分子质量或相对原子质量相同 | |
| D. | 若x个N(氮)原子的质量是1g,则阿伏加德罗常数可表示为14x mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
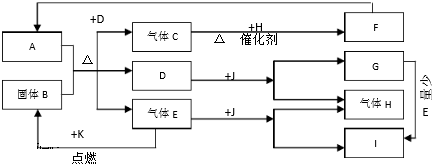
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
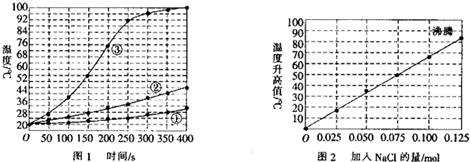
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com