

分析 A、B为常见的非金属单质且均为气体;甲、乙为金属单质,C为碱性气体判断为NH3,A、B为H2和N2,C和O2反应生成D和E,D和氧气反应生成G,说明D为NO,G为NO2,反应④为G与水的反应生成硝酸和D为一氧化氮,则I为HNO3,E为H2O,金属甲和水反应生成H,H、J的溶液焰色反应均呈黄色,说明含钠元素,乙在I的浓溶液中发生钝化,乙和H反应,证明金属单质乙应为Al,结合转化及溶液的碱性,则甲为Na,E为水,H为NaOH,乙为Al,反应⑥为Al与NaOH溶液反应,则J为NaAlO2,A为H2,然后结合物质的性质及题目要求来解答,
(1)实验室利用氯化铵和氢氧化钙固体加热制备氨气,氨气催化氧化生成一氧化氮和水;
(2)反应④是3NO2+H2O═HNO3+NO,结合化学方程式定量关系计算;
(3)反应⑥是铝和氢氧化钠溶液的反应,反应生成偏铝酸钠和氢气;
(4)硝酸见光易分解;
(5)乙和I的稀溶液反应后的溶液为硝酸铝溶液,与C的水溶液为氨水溶液,是铝离子和一水合氨生成氢氧化铝沉淀和铵根离子的反应.
解答 解:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,C为碱性气体判断为NH3,A、B为H2和N2,C和O2反应生成D和E,D和氧气反应生成G,说明D为NO,G为NO2,反应④为G与水的反应生成硝酸和D为一氧化氮,则I为HNO3,E为H2O,金属甲和水反应生成H,H、J的溶液焰色反应均呈黄色,说明含钠元素,乙在I的浓溶液中发生钝化,乙和H反应,证明金属单质乙应为Al,结合转化及溶液的碱性,则甲为Na,E为水,H为NaOH,乙为Al,反应⑥为Al与NaOH溶液反应,则J为NaAlO2,A为H2,(1)实验室制备C为氨气,常用的物质是NH4Cl和Ca(OH)2固体混合加热反应生成氨气,反应②的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:Ca(OH)2,4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)由3NO2+H2O═HNO3+NO可知,3molG参加反应转移2mol电子,则每消耗1molG,转移电子的物质的量为$\frac{2}{3}$mol,故答案为:$\frac{2}{3}$;
(3)反应⑥的离子方程式为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(4)I为硝酸,见光易分解,则保存在棕色试剂瓶中,放在阴凉处,故答案为:保存在棕色试剂瓶中,放在阴凉处;
(5)乙为Al与I为HNO3的稀溶液反应后的溶液为Al(NO3)3,与C为NH3的水溶液发生反应生成氢氧化铝沉淀和硝酸铵,反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物的推断,注意钝化及溶液的碱性来推断各物质是解答的关键,C为氨气是解答本题的突破口,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 若铜有剩余,则向反应后的溶液中再滴加硫酸,铜也不能溶解 | |
| B. | 若金属全部溶解,则反应后的溶液中一定含有Cu2+、Fe3+离子 | |
| C. | 若铁粉全部转化为Fe2+离子,则b的值为0.8 | |
| D. | 若反应后的溶液中n(Fe3+):n(Fe2+)=3:2,则产生的NO为5152 mL(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、Cl-、ClO- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Mg2+、NH4+、SO42-、Cl- | D. | Na+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )
在如图所示的电解质溶液的导电性装置中,若向某-电解质溶液中逐滴加入另一种溶液时.则灯光由亮变暗至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 醋酸中逐滴加入氢氧化钠溶液 | ||
| C. | 氢氧化钡溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (b-a)/4 kJ•mol-1 | B. | (b-a+1.4c)/4 kJ•mol-1 | ||
| C. | (b-a+5.6c)/4 kJ•mol-1 | D. | b-a+1.4c kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
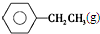 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$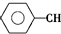 ≡CH2(g)+H2(g)的反应热△H为( )
≡CH2(g)+H2(g)的反应热△H为( )| A. | -124 kJ/mol | B. | +124 kJ/mol | C. | -40 kJ/mol | D. | +40 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com