
【题目】印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
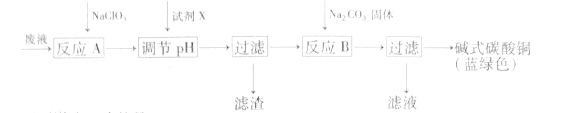
下列说法正确的是( )
A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O
B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜
C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化
D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去
【答案】B
【解析】
印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-)加入NaClO3发生氧化还原反应,将亚铁离子氧化为铁离子,加入CuO调节溶液的pH值,过滤,向滤液中加入碳酸钠反应得到碱式碳酸铜。
A. 反应A中Fe2+与ClO3-反应生成Fe3+和Cl-,其离子方程式为:6Fe2+ + ClO3-+6H+ = 6Fe3+ + Cl- + 3H2O,故A错误;
B. 铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜,故B正确;
C. NaClO3中心原子杂化类型为sp3杂化,Na2CO3中心原子杂化类型为sp2杂化,故C错误;
D. 试剂X可为CuO,主要作用是通过调节pH值将Fe3+转化为Fe(OH)3过滤除去,故D错误。
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足图中所示物质转化关系且经过一步就能实现的是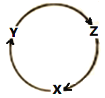
选项 | X | Y | Z |
A | Na | NaOH | Na2O2 |
B | Fe | FeCl2 | Fe(OH)3 |
C | NO | NO2 | HNO3 |
D | Al | Al2O3 | Al(OH)3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等密切相关,从化学视角回答下列问题:
(1)电闪雷鸣的雨天,空气中发生的化学反应会增加雨水的含氮量,有关反应的化学方程式是_____、_______、_________________。
(2)我国以煤炭为主的能源结构决定了我国的酸雨以硫酸型为主,为减少SO2的污染和酸雨的形成,目前常应用石灰法脱硫。过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,最终生成CaSO4,有关反应的化学方程式为_______、______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置制取有机物,下列说法错误的是( )

A.根据温度计读数的不同,可制取乙烯和乙醚
B.b为恒压滴液漏斗,其优点是便于液体顺利滴下
C.将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D.浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应: H2(g) + I2(g) ![]() 2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)反应到第___________分钟达到平衡状态。
(2)2 min内,v(H2) =______________mol/(L·min)。
(3)下列能证明该反应已经达到平衡的是________(填字母)。
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为_______________。②H2的平衡转化率是__________________。
(5)升高温度,化学平衡常数K要___________(填“变大”或“变小”)。
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=______________mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )

A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com