
| A. | ${\;}_{17}^{37}$Cl2的摩尔质量是74 | |
| B. | ${\;}_{17}^{37}$Cl、${\;}_{17}^{35}$Cl互为同位素,${\;}_{17}^{35}$Cl2与Cl2互为同分异构体 | |
| C. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| D. | 能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2 |
分析 A.摩尔质量的单位是g/mol;
B.同分异构体指分子式相同结构不同的化合物;
C.根据氯气的价态判断氯气的性质,处于中间价态的物质既有氧化性又有还原性;
D.具有氧化性,与KI反应生成单质碘的物质,能使湿润的KI淀粉试纸变蓝.
解答 解:A.1737Cl2的摩尔质量是74g/mol,故A错误;
B.${\;}_{17}^{35}$Cl2与Cl2分子式相同,是同一物质不是同分异构体,故B错误;
C.氯气中氯元素的化合价是0价,处于中间价态,所以既有氧化性又有还原性,故C正确;
D.具有氧化性,与KI反应生成单质碘的物质,能使湿润的KI淀粉试纸变蓝,不一定是氯气,故D错误.
故选C.
点评 本题考查了物理量的单位、同素异形体的判断、元素性质与化合价的关系等知识点,易错选项是C,注意基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
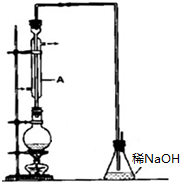 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ Cl- SO42- | B. | K+ Na+ Cl- HCO3- | ||
| C. | Fe2+ K+ NO3- SO42- | D. | K+ Ba2+ NO3- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂和蛋白质都是高分子化合物 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,但二者分子中官能团不同 | |
| D. | 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
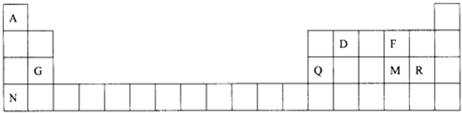
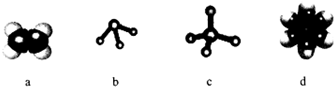
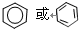 .
.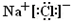 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com