
关于电化学的下列说法正确的是

A.工业上用电解MgCl2溶液的方法冶炼Mg
B.钢铁发生吸氧腐蚀的正极反应式为4OH﹣-4e﹣═O2↑+2H2O
C.如图14-C中发生反应的方程式为:Fe+2H+=Fe2++H2↑
D.碱性锌锰干电池放电时的正极反应为: MnO2+H2O+e-=MnOOH+OH-
科目:高中化学 来源:2016届山东省高三5月模拟一理综化学试卷(解析版) 题型:选择题
下列有关电解质溶液中粒子浓度关系正确的是
A.pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1
B.含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)]
C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三下学期考前练习化学试卷(解析版) 题型:选择题
工业上常利用铝粉和氧化铁反应来焊接铁轨。下列说法正确的是
A.氧化铝、氧化铁均为两性氧化物
B.氧化铝中的微粒半径:r(Al3+)>r(O2-)
C.在该反应中,铝的还原性强于铁的还原性
D.1mol 氧化铁参加反应转移电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:实验题
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为 FeO•Cr2O3,还含有A12O3、SiO2 等杂质)为主要原料生产,其主要工艺流程如下:
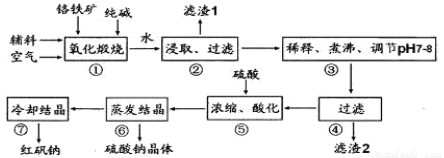
步骤①中主要反应的化学方程式为:4FeO•Cr2O3+8Na2CO3+7O2 =8Na2CrO4+2Fe2O3+8CO2
(1)杂质 A12O3、SiO2在①中转化后经加水过滤进入滤液,写出 A12O3在①中转化的化学反应方程式____________________________________。
(2)用化学平衡移动原理说明③中煮沸的作用是____________(用离子方程式结合文字说明)
(3)⑤中酸化是使 CrO42一转化为 Cr2O72一,若1L酸化后所得溶液中含铬元素的质量为 28.6 g,CrO42-有 转化为 Cr2O72-。
转化为 Cr2O72-。
①酸化后所得溶液中 c(Cr2O72- )=________
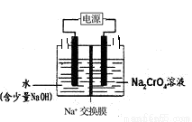
②工业上也可设计图示装置(两极均为惰性电极)电解Na2CrO4溶液制取 Na2Cr2O7,图中右侧电极的电极反应式为_________________________。若电解前两侧溶液的质量相等,则当电解过程中转移了1mol 电子时两侧溶液的质量差为______________g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
向2L 的密闭容器中充入7.6molNO 和 3.8mol O2 ,发生如下反应:
①2NO(g)+O2(g) 2NO2 (g) ②2NO2 (g)
2NO2 (g) ②2NO2 (g)  N2O4 (g)测得 NO2和N2O4 的浓度变化如图所示,0~10min 维持容器温度为T1℃,10min 后升高并维持容器的温度为 T2℃。下列说法正确的是
N2O4 (g)测得 NO2和N2O4 的浓度变化如图所示,0~10min 维持容器温度为T1℃,10min 后升高并维持容器的温度为 T2℃。下列说法正确的是
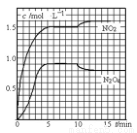
A.前 5min 反应的平均速率 v(N2O4)=0.36mol·L-1 ·min-1
B.T1℃时反应②的化学平衡常数K=0.6
C.若起始时向该容器中充入3.6molNO 2和 2.0mol N2 O4 ,T 1 ℃达到平衡时,N2O4的转化率为10%
D.反应①、②均为吸热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
已知一定条件下体积不变的密闭容器中(各物质均为气态),1 mol N2和3 mol H2充分反应生成 NH3放热为Q1 kJ,下列说法正确的是
A.上述反应的热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=- Q 1 kJ/mol
2NH3(g) ΔH=- Q 1 kJ/mol
B.相同条件下1 mol N2 (g)和 3 mol H2(g) 的总键能小于2molNH3(g)的总键能
C.相同条件下将2 molN2 和6molH2置于相同容器中充分反应后放出的热量为 Q 2 kJ,Q2 =2Q1
D.相同条件下气体密度不变时,可以判断反应 N2(g)+3H2 (g) 2NH3 (g)达到平衡状态
2NH3 (g)达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
设N A为阿伏加德罗常数的值,下列叙述正确的是
A.60gSiO 2晶体有σ键4N A
B.在标准状况下,2.24 LSO3中含有的氧原子数为0.3NA
C.t℃时,MgCO3的 Ksp=4×10-6,则饱和溶液中含 Mg2+数目为2×10-3NA
D.标准状况下,2.24LCl2通入足量H2O溶液中转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g) 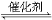 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。
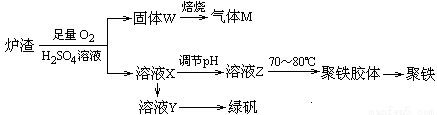
A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:实验题
乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:
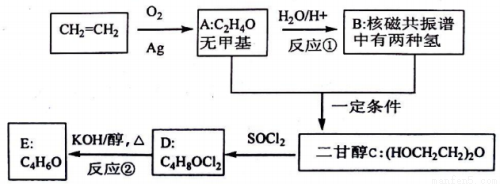
(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com