
| A、NaOH溶液能导电,所以NaOH溶液为电解质 |
| B、氯化钠晶体不能导电,所以氯化钠为非电解质 |
| C、虽然液态氯化氢不导电,但氯化氢属于电解质 |
| D、液态的铜导电性很好,所以铜是电解质 |


科目:高中化学 来源: 题型:
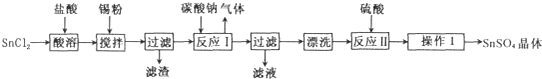
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | FeCl3溶液可溶解废旧电路板中的铜 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | NH3有还原性 | NH3可用H2SO4吸收 |
| D | 浓HNO3有酸性 | 浓HNO3不可用铁制容器盛放 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入一定量pH=2的醋酸,混合后所得的溶液中:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+) |
| B、向其中加入一定量的水,NH3?H2O的电离平衡正移,溶液中所有离子浓度均减小 |
| C、与等体积、pH=2的盐酸混合后所得的溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(NH3?H2O)=1.0×10-12 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+2 | B、+3 | C、+4 | D、+5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在溴水中存在如下平衡:Br2+H2O=HBr+HBrO,当加入NaOH溶液后颜色变浅 |
| B、对2HI?H2+I2(气)平衡体系增加压强使颜色变深 |
| C、反应CO+NO2?CO2+NO(△H<0)升高温度使平衡向逆方向移动 |
| D、合成氨反应:N2+3H2?2NH3(△H<0),为使氨的产率提高,理论上应采取低温高压的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属的电化学腐蚀和化学腐蚀都是金属原子失去电子而被还原的过程 |
| B、钢铁发生电化学腐蚀时,其先发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
| C、减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
| D、金属的腐蚀会给社会带来巨大损失,所以金属的腐蚀是百害无一利的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z简单离子的半径依次增大 |
| B、将M溶液加热蒸干并灼烧,最后可得Y的氧化物 |
| C、Y的最高价氧化物为碱性氧化物 |
| D、将少量X单质投入到M溶液中,会置换出Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mn2O3 |
| B、Mn2+ |
| C、MnO2 |
| D、K2MnO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com