
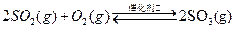

 ��
�� �����
����� ,
,
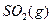 ������
������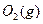 ��ַ�Ӧ����
��ַ�Ӧ����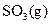 ���ų�����
���ų����� 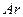 b����ƽ�������г���
b����ƽ�������г���
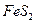 ��ȫ����
��ȫ����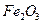 ������ʱҪʹ�ù�����
������ʱҪʹ�ù�����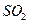 ��
��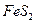 �ڿ�������ȫ���գ����ù���
�ڿ�������ȫ���գ����ù���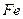 ��
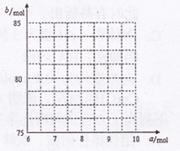
��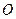 �����ʵ���֮��n(
�����ʵ���֮��n(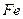 )��n(
)��n(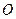 )="6:"
)="6:"  ��
�� mol��
mol�� ��
�� �Ĺ�ϵ���ߡ�
�Ĺ�ϵ���ߡ�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
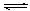 SO3��g������H=" ��98" kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= ��
SO3��g������H=" ��98" kJ�� mol��1����ʼʱ��10L���ܱ������м���4.0mol SO2(g)��5.0molO2(g)������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K= �� 2SO3��g���ﵽƽ���ı���������SO3�����������������
2SO3��g���ﵽƽ���ı���������SO3����������������� 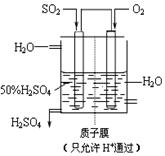
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����᳧Ӧ�ý��ڿ���ԭ�ϲ��صĵ��� |
| B���Ӵ������������Ҫ�������������Ӵ�������������������� |
| C�����ڳ�ѹ��SO2ת��ΪSO3��ת���ʺܸߣ�����SO2�Ӵ�����ʱ�����ø�ѹ�ķ�Ӧ���� |
| D����ҵ�����ϡ����ۺ����ò����ܼ�����Ⱦ����������õĸ���Ʒ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������2x% | B��С��2x% | C������2x% | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��SO2+Br2+2H2O H2SO4+2HBr��2HBr+H2SO4(Ũ) H2SO4+2HBr��2HBr+H2SO4(Ũ)  Br2+SO2��+2H2O��Ϊ���淴Ӧ Br2+SO2��+2H2O��Ϊ���淴Ӧ |
| B������������Ӧ������У��������淴Ӧ������еķ�Ӧ�п��淴Ӧ |
| C����ͬһ�����£�ͬʱ������������������еķ�Ӧ�п��淴Ӧ |
| D����һ�������£�SO2��������SO3�ķ�Ӧ�ǿ��淴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢ� | B���ۢ� | C���ۢ� | D���٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ȿ������������ֿ�����ԭ�� | B��SO3ֻ�������ԣ�SO2ֻ�л�ԭ�� |
| C�������������������Ũ���� | D����������������ԣ����л�ԭ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com