
A、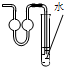 少量氨气的尾气吸收装置 |
B、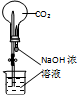 二氧化碳的喷泉实验 |
C、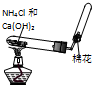 制备和收集氨气 |
D、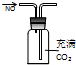 收集NO气体 |


科目:高中化学 来源: 题型:
| A、非标准状况下,2.24LCH4含有的氢原子数可能是0.4NA |
| B、0.1mol?L-1K2CO3溶液中含有K+数目为0.2NA |
| C、1mol苯乙烯(C6H5CH=CH2)中含有的碳碳双键数目为4NA |
| D、标准状况下,2.24 L SO3中含有0.3 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
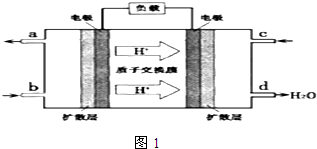 PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx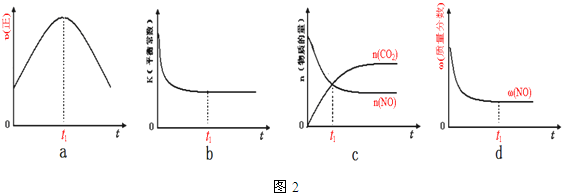
查看答案和解析>>
科目:高中化学 来源: 题型:
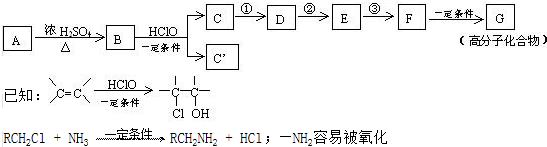
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
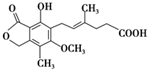 ,有关麦考酚酸说法错误的是( )
,有关麦考酚酸说法错误的是( )| A、能与FeCl3溶液发生显色反应 |
| B、在一定条件下可发生加成、取代、消去反应 |
| C、1 mol麦考酚酸最多能与4 mol H2反应 |
| D、1 mol麦考酚酸最多能与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
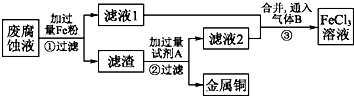 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作腐蚀液原料循环使用.
印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作腐蚀液原料循环使用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35Cl原子所含质子数为18 |
| B、0.1 mol HCl所分子数约为6.02×1022 |
| C、3.5 g的35Cl2气体的体积为2.24 L |
| D、2 mol35Cl2气体的质量为140 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com